
【题目】狼毒素来自香科植物,具有止痛、杀虫的功效。N是合成狼毒素的重要中间体,其合成路线如下:
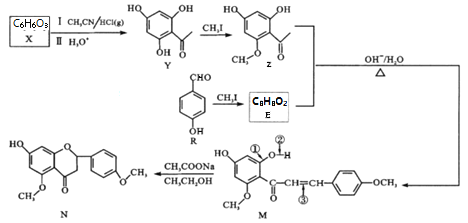
(1)R中含氧官能团名称______;Y→Z的反应类型_______。
(2)1molZ与NaOH溶液反应,最多消耗NaOH为_____mol;反应R→E的化学方程式为_________。
(3)下列能测出N的相对分子质量的仪器是_____(填字母序号)。
A.元素分析仪 B.质谱仪 C.核磁共振仪 D.红外光谱仪
(4)反应M→N中M的断键位置为______(填数字序号)。
(5)同时满足下列条件的Y的同分异构体有_____种。
①苯环上有3个取代基; ②为芳香族化合物且属于酯类;
③遇氯化铁溶液显紫色; ④苯环上一氯代物有2种。
(6)以丙酮和![]() 为原料合成某有机中间体(
为原料合成某有机中间体( ),参照上述路线,设计路线__________________________。
),参照上述路线,设计路线__________________________。
【答案】 醛基、羟基 取代反应 2 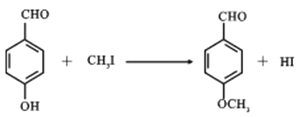 B ②③ 6
B ②③ 6 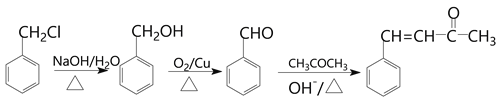
【解析】题目不要求X的相关问题,所以从Y开始推测。Y到Z发生取代反应,将Y中下方酚羟基的上的氢原子换成甲基,得到Z;则R发生相同的反应得到E(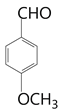 )。
)。
(1)R中含氧官能团为羟基和醛基。Y→Z的反应类型为取代反应。
(2)Z中有两个酚羟基可以与氢氧化钠中和,其余官能团都不反应,所以1molZ与NaOH溶液反应,最多消耗NaOH为2mol。反应R→E就是将羟基上的氢原子换成甲基,所以方程式为: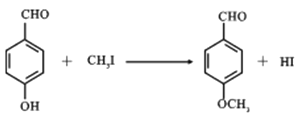 。
。
(3)物质分析中一般用质谱仪得到化合物的分子量,所以答案为B。元素分析仪是用来测定各元素含量的,核磁共振仪是测定氢原子的种类和数目的,红外光谱仪是测定分子中的特定化学键或官能团的。
(4)M→N的反应类型为加成,用②处的氧和氢对③处的碳碳双键进行加成,所以断键位置为②③。参考下图: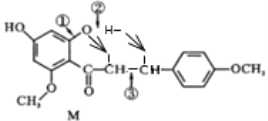
(5)Y的分子式为C8H8O4,根据题目的4个条件得到:分子有苯环,苯环上的三个取代基一定是两个相同一个不同,且关于中间对称。因为不可能有两个酯基,所以只能是关于两个酚羟基对称,即可以是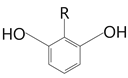 或
或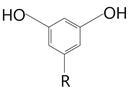 ,再考虑R中一定有酯基,且R中一共两个碳,所以R可以是:-COOCH3、-CH2OOCH、-OOCCH3,即R一共有3种,则该有机物一共有6种。
,再考虑R中一定有酯基,且R中一共两个碳,所以R可以是:-COOCH3、-CH2OOCH、-OOCCH3,即R一共有3种,则该有机物一共有6种。
(6)根据题目中的Z和E反应得到M的过程,将目标产物拆解为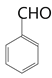 和
和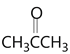 (丙酮)。将
(丙酮)。将![]() 水解再氧化就可以得到
水解再氧化就可以得到 ,所以流程图为:
,所以流程图为:


科目:高中化学 来源: 题型:
【题目】在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如右图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为( )

A. 6:1 B. 3:1 C. 2:1 D. 1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、Ti的单质及其化合物在现代社会有广泛用途。
(1)基态钛原子的电子排布式为________。
(2)CS2分子中含有σ键和π键之比为______;NO2+与CO2是等电子体,NO2+的电子式为___,键角为_______。
(3)CH3CHO沸点低于CH3CH2OH的原因是_____;CH3CHO分子中碳原子杂化类型为_____。
(4)钛酸钡(BaTiO3)晶体的某种晶胞如图所示。NA为阿伏加德罗常数值,Ba2+、O2-、Ti4+的半径分别为apm、bpm、cpm。

①与钡离子等距离且最近的氧离子有______个;
②假设晶体中的Ti4+、Ba2+分别与O2-互相接触,则该晶体的密度表达式为______g.cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式的书写,正确的是
A. NH3·H2O==NH4+ + OH― B. H2SO4==2H+ + SO42―
C. CuCl2== Cu2+ + Cl― D. NaHCO3==Na+ + H+ + CO32―
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子检验的说法正确的是
A. 加入稀盐酸产生无色气体,气体能使澄清石灰水变浑浊,原溶液中一定含有CO![]()
B. 加入稀盐酸无明显现象,再加入硝酸银溶液产生白色沉淀,原溶液中一定含有Cl―
C. 加入BaCl2溶液产生白色沉淀,再加入稀盐酸沉淀不溶解,原溶液中一定含有SO![]()
D. 加入KSCN溶液,呈现血红色,原溶液中一定含有Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把a,b,c三块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;b、c相连时,c不易被腐蚀。则三种金属的活动性由强到弱的顺序为
A. a>b>c B. a>c>b C. c>b>a D. b>c>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱是重要的化工原料,在医药、冶金、化工、食品等领域被广泛使用。
I. 用纯净的碳酸钠固体配制500mL 0.40mol/L Na2CO3溶液。
(1)称取Na2CO3固体的质量是______________________g。
(2)配制溶液时,进行如下操作,按照操作顺序,第4步是_________(填字母)。
a. 定容 b. 计算 c. 溶解 d. 摇匀 e. 转移 f. 洗涤 g. 称量
(3)下列说法中,正确的是_____________________(填字母)。
a. 定容时,仰视刻度线,会导致配制的溶液浓度偏小
b. 定容时,如果加水超过刻度线,要用滴管吸出
c. 转移时,溶液倒出容量瓶外,要重新配制溶液
d. 摇匀后,液面低于刻度线,要再加水至刻度线
II. 某实验小组的同学模拟侯德榜制碱法制取纯碱,流程如下:

(1)工业生产纯碱的第一步是除去饱和食盐水的中SO42―、Ca2+离子,依次加入的试剂及其用量是 ______________、 _______________、 (过滤)、 _______________。
(2)已知:几种盐的溶解度
NaCl | NH4HCO3 | NaHCO3 | NH4Cl | |
溶解度(20°C,100gH2O时) | 36.0 | 21.7 | 9.6 | 37.2 |
①写出装置I中反应的化学方程式________________________________________。
②写出装置II中发生反应的化学方程式________________________________。
(3)该流程中可循环利用的物质是__________________。
(4)制出的纯碱中只含有杂质NaCl。
①检验用该纯碱配制的溶液中含有Cl―的方法是_________________________。
②测定该纯碱的纯度,下列方案中可行的是__________(填字母)。
a. 向m克纯碱样品中加入足量CaCl2溶液,沉淀经过滤、洗涤、干燥,称其质量为b g
b. 向m克纯碱样品中加入足量稀盐酸,用碱石灰(主要成分是CaO和NaOH)吸收产生的气体,碱石灰增重b g
c. 向m克纯碱样品中加入足量AgNO3溶液,产生的沉淀经过滤、洗涤、干燥,称其质量为b g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车净化的主要原理为2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g) △H<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且说明反应在进行到t1时刻达到平衡状态的是
2CO2(g)+N2(g) △H<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且说明反应在进行到t1时刻达到平衡状态的是
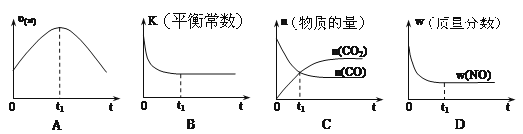
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com