
【题目】下表是元素周期表的一部分,表中字母分别表示一种元素。请回答下列问题:
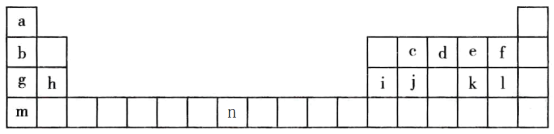
(1)a的三种核素分别为______、______、______。(用汉字表示)
(2)j是一种良好的____________材料,写出元素j的氧化物的一种用途____________。
(3)a、d、f、g四种元素的原子半径由小到大的顺序为________(用元素名称表示)。
(4)c、d、j、l四种元素最高价氧化物对应的水化物的酸性由强到弱的顺序为______(用化学式表示)。
(5)上述元素形成的氢化物中最稳定的是_____,溶于水显碱性的是_____。
(6)e、k 两种元素得电子能力强的是_____ (用元素符号表示)
(7)元素g、e 形成的原子个数1:1的化合物的化学式为_____,阴阳离子个数比为为______。
【答案】氕 氘 氚 半导体 光导纤维(其他答案正确即可) H<F<N<Na HClO4>HNO3 >H2CO3>H2SiO3 HF NH3 O Na2O2 1:2
【解析】
H的三种核素分别为氕、氘、氚;a(H)、d(N)、f(F)、g(Na)四种元素的原子半径根据层多径大和电子层结构相同,核多径大原则;⑷根据非金属性越强,其最高价氧化物对应水化物酸性越强;非金属越强,氢化物越稳定;非金属性越强,得电子能力越强。
⑴a的三种核素分别为氕、氘、氚;故答案为:氕;氘;氚。
⑵j是一种良好的半导体材料,元素j的氧化物为SiO2,其一种用途制造光导纤维;故答案为:半导体;光导纤维。
⑶a(H)、d(N)、f(F)、g(Na)四种元素的原子半径根据层多径大和电子层结构相同,核多径大原则,因此由小到大的顺序为H<F<N<Na;故答案为:H<F<N<Na。
⑷根据非金属性越强,其最高价氧化物对应水化物酸性越强,因此c(C)、d(N)、j(Si)、l(Cl)四种元素最高价氧化物对应的水化物的酸性由强到弱的顺序为HClO4 >HNO3 >H2CO3>H2SiO3;故答案为:HClO4>HNO3 >H2CO3>H2SiO3。
⑸非金属越强,氢化物越稳定,因此上述元素形成的氢化物中最稳定的是HF,溶于水显碱性的是NH3;故答案为:HF;NH3。
⑹非金属性越强,得电子能力越强,因此e、k 两种元素得电子能力强的是O;故答案为:O。
⑺元素g、e 形成的原子个数1:1的化合物的化学式为Na2O2,含有钠离子和过氧根离子,因此阴阳离子个数比为1:2;故答案为:Na2O2;1:2。


科目:高中化学 来源: 题型:
【题目】硫酸是一种重要的化工产品,2SO2+O2![]() 2SO3是生产过程中的重要反应。下列对于该反应的说法中正确的是
2SO3是生产过程中的重要反应。下列对于该反应的说法中正确的是
A.只要选择适宜的条件,SO2和O2就能全部转化为SO3
B.该反应达到平衡后,反应就完全停止了,即正逆反应速率均为零
C.如果反应前充入由18O原子组成的O2,反应达到平衡状态时,18O只存在于O2和SO3中
D.在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组以CoCl2·6H2O、NH4Cl、H2O2、液氨、氯化铵为原料,在活性炭催化下合成了橙黄色晶体X。为测定其组成,进行如下实验。
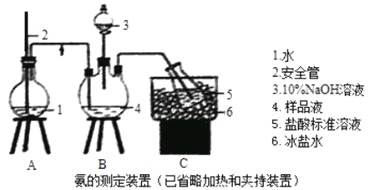
①氨的测定:精确称取wgX,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品溶液中的氨全部蒸出,用V1mLc1mol·L—1的盐酸溶液吸收。蒸氨结束后取下接收瓶,用c2mol·L—1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现砖红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是_________。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用_____式滴定管,可使用的指示剂为________。
(3)样品中氨的质量分数表达式为____________。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将___(填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是___________;滴定终点时,若溶液中c(Ag+)=2.0×10—5mol·L—1,c(CrO42—)为______mol·L—1。(已知:Ksp(Ag2CrO4)=1.12×10—12)
(6)经测定,样品X中钴、氨、氯的物质的量之比为1:6:3,钴的化合价为______,制备X的化学方程式为____________________;X的制备过程中温度不能过高的原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为![]() )提取氧化铝作冶炼铝的原料,提取的操作过程如下:
)提取氧化铝作冶炼铝的原料,提取的操作过程如下:

(1)反应1结束后的操作名称为_______。
(2)滤渣的主要成分是___________________。
(3)反应2中通入的过量气体为________
a. 二氧化碳 b.氨气 c.氮气
(4)写出B煅烧生成Al2O3的化学反应方程式:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋及其化合物在工业生产中用途广泛,某研究小组用浮选过的辉铋矿![]() 主要成分是
主要成分是![]() ,还含少量
,还含少量![]() 等杂质
等杂质![]() 制备
制备![]() ,其流程如下:
,其流程如下:

已知:![]() 水解能力:
水解能力:![]()
![]() 。
。
回答下列问题:
(1)“浸取”时,为了提高浸取速率,可采取的措施有___________![]() 任写一条
任写一条![]() ;过滤1的滤渣的主要成分有______________
;过滤1的滤渣的主要成分有______________![]() 填化学式
填化学式![]() 。
。
(2)浸取时加入过量浓盐酸的目的是____________________________________。
(3)写出焙烧时生成铋酸钠的化学方程式_________________________________。
(4)![]() 时,向浓度均为
时,向浓度均为![]() 的
的![]() 、
、![]() 的混合溶液中滴加
的混合溶液中滴加![]() 溶液
溶液![]() 设溶液体积增加1倍
设溶液体积增加1倍![]() ,当
,当![]() 时恰好完全沉淀,判断此时
时恰好完全沉淀,判断此时![]() 是否已经开始沉淀________
是否已经开始沉淀________![]() 填“是”或“否”
填“是”或“否”![]() 已知:
已知:![]() 、
、![]()
(5)用双硫腙![]() ,二元弱酸
,二元弱酸![]() 络合萃取法可从工业废水中提取金属离子:
络合萃取法可从工业废水中提取金属离子:![]() 先将金属离子络合成电中性的物质
先将金属离子络合成电中性的物质![]() 如
如![]() 等
等![]() ,再用
,再用![]() 萃取此络合物。下图是用上述方法处理含有
萃取此络合物。下图是用上述方法处理含有![]() 、
、![]() 、
、![]() 的废水时的酸度曲线
的废水时的酸度曲线![]() 表示金属离子以络合物形式被萃取分离的百分率
表示金属离子以络合物形式被萃取分离的百分率![]() 。
。

![]() 当调节
当调节![]() 时,铋
时,铋![]() 的存在形式为____________。
的存在形式为____________。
![]() 向萃取后的
向萃取后的![]() 中加入过量NaOH溶液可将铋元素以氢氧化物的形式沉淀下来,相应的离子方程式为____。
中加入过量NaOH溶液可将铋元素以氢氧化物的形式沉淀下来,相应的离子方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯酸是合成丙烯酸脂的原料,丙烯醇用于生产甘油、塑料等。某小组以丙烯醛为原料生产丙烯醇、丙烯酸的流程如图所示:
 已知反应原理:
已知反应原理:![]()
![]()
有关物质的物理性质如表:
| 丙烯醛 | 丙烯醇 | 丙烯酸 | 四氯化碳 |
沸点/℃ | 53 | 97 | 141 | 77 |
熔点/℃ | -87 | -129 | 13 | -22.8 |
密度/gcm-3 | 0.84 | 0.85 | 1.02 | 1.58 |
溶解性(常温) | 易溶于水和 有机物 | 溶于水和 有机溶剂 | 溶于水和 有机溶剂 | 难溶于水, 易溶于有机物 |
(1)已知苯的沸点为80.1℃,上述步骤②的萃取剂用四氯化碳而不用苯,其主要原因可能是_________________。上层液体分液漏斗________(填“上”或“下”)口倒(或放)出。
(2)从步骤④的残留液中可提取一种无水正盐,它是________(填化学式)。
(3)步骤⑤采用如图装置,该装置有一处明显错误,请指出错误:________,并改之。收集丙烯醇的温度应控制在________左右。

(4)已知:醛类具有较强还原性,能与溴水、酸性高锰酸钾溶液、银氨溶液等反应。某同学为了证明丙烯酸产品中含有丙烯醛,设计如下方案:
a.取少量溴水于试管,加入适量丙烯酸样品,振荡,溶液褪色
b.取少量酸性高锰酸钾溶液于试管,加入适量丙烯酸样品,振荡,溶液褪色
c.取少量银氨溶液于试管,加入适量丙烯酸样品,用水浴加热,有银镜产生
d.取少量酸性重铬酸钾溶液于试管,加入适量丙烯酸样品,振荡,溶液由橙红色变成绿色
上述方案中,能证明丙烯酸产品中含少量丙烯醛的是________(填字母)。
(6)为了证明丙烯酸是弱酸,设计如下方案,其中能达到实验目的的是________(填字母)。
代号 | 方案 | 预测现象 |
A | 取少量 | 溶液变红色 |
B | 常温下,将10ml0.1molL-1NaOH溶液和10ml0.1molL-1 | pH>7 |
C | 用相同的导电仪分别测定盐酸溶液、 | 前者灯泡较亮 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期中的18种元素具有重要的用途,在现代工业中备受青睐。
(1)钛原子的价电子排布式为______________________,TiCl4沸点136℃,熔点-25℃,晶体类型为___________晶体。
(2)铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是______________________。
(3)与As同主族的短周期元素是N、P。AsH3中心原子轨道杂化的类型_________________;一定压强下将AsH3、NH3和PH3的混合气体降温时液化顺序是______________________,理由是______________________。
(4)铬是一种硬而脆抗腐蚀性强的金属,常用于电镀和制造特种钢。下图1为铬的晶胞结构图,则铬晶胞属于___________堆积;该晶胞中原子的体积占晶胞体积的百分率为___________。

(5)钴晶体的一种晶胞(如图2所示)的边长为anm,密度为ρg·cm-3,NA表示阿伏加德罗常数的值,则钴原子半径为___________mm,钴的相对原子质量可表示为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁泥是硼镁矿生产硼砂晶体![]() 时的废渣,其主要成分是MgO,还含有
时的废渣,其主要成分是MgO,还含有![]() 、CaO、
、CaO、![]() 、FeO、MnO、
、FeO、MnO、![]() 等杂质。以硼镁泥为原料制取七水硫酸镁的工艺流程如下:
等杂质。以硼镁泥为原料制取七水硫酸镁的工艺流程如下:
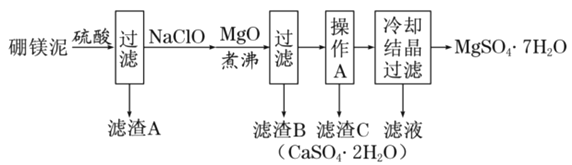
回答下列问题:
(1)![]() 中B的化合价为__________。
中B的化合价为__________。
(2)![]() 易溶于水,也易发生水解:
易溶于水,也易发生水解:![]() 硼酸
硼酸![]() 硼酸在常温下溶解度较小
硼酸在常温下溶解度较小![]() 。写出加入硫酸时
。写出加入硫酸时![]() 发生反应的化学方程式:_____。
发生反应的化学方程式:_____。
(3)滤渣B中含有不溶于稀盐酸但能溶于热浓盐酸的黑色固体,写出生成黑色固体的离子方程式____________。
(4)加入MgO的目的是___________________。
(5)已知![]() 、
、![]() 的溶解度如下表:
的溶解度如下表:
温度 | 40 | 50 | 60 | 70 |
|
|
|
|
|
|
|
|
|
|
“操作A”是将![]() 和
和![]() 混合溶液中的
混合溶液中的![]() 除去,根据上表数据,简要说明“操作A”步骤为____________________。
除去,根据上表数据,简要说明“操作A”步骤为____________________。
(6)硼砂也能在工业上制取![]() ,
,![]() 被称为有机化学中的“万能还原剂”。
被称为有机化学中的“万能还原剂”。
![]() 写出
写出![]() 的电子式:___________。
的电子式:___________。
![]() “有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克
“有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克![]() 的还原能力。
的还原能力。![]() 的有效氢含量为_________
的有效氢含量为_________![]() 保留两位小数
保留两位小数![]() 。
。
![]() 在碱性条件下,在阴极上电解
在碱性条件下,在阴极上电解![]() 也可制得硼氢化钠,写出阴极室的电极反应式:________。
也可制得硼氢化钠,写出阴极室的电极反应式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油是一种重要的资源。A~F是常见有机物,它们之间的转化关系如图1所示(部分产物和反应条件已略去),其中A的产量可以用来衡量一个国家的石油化工发展水平,E是最简单的芳香烃。回答下列问题:

(1)步骤②所用试剂X为___________(写化学式),D的官能团名称是_______;
(2)F的结构简式为________________,步骤①的反应类型:___________;
(3)写出下列步骤中的化学方程式(注明反应条件):
步骤③_____________________________________;
步骤④_______________________________________;
(4)用图2所示实验装置制取乙酸乙酯。请回答:试管b中所装溶液应为_____,乙酸乙酯生成后,分离出产品时的操作方法是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com