
【题目】第四周期中的18种元素具有重要的用途,在现代工业中备受青睐。
(1)钛原子的价电子排布式为______________________,TiCl4沸点136℃,熔点-25℃,晶体类型为___________晶体。
(2)铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是______________________。
(3)与As同主族的短周期元素是N、P。AsH3中心原子轨道杂化的类型_________________;一定压强下将AsH3、NH3和PH3的混合气体降温时液化顺序是______________________,理由是______________________。
(4)铬是一种硬而脆抗腐蚀性强的金属,常用于电镀和制造特种钢。下图1为铬的晶胞结构图,则铬晶胞属于___________堆积;该晶胞中原子的体积占晶胞体积的百分率为___________。

(5)钴晶体的一种晶胞(如图2所示)的边长为anm,密度为ρg·cm-3,NA表示阿伏加德罗常数的值,则钴原子半径为___________mm,钴的相对原子质量可表示为___________。
【答案】3d24s2 分子 气态Cu失去一个电子变成结构为[Ar]3d10的Cu+,此时3d轨道处于全满的稳定状态,所以Cu的第二电离能相对较大,而气态Zn失去一个电子变成结构为[Ar]3d104s1的Zn+,易再失去一个电子,所以Zn的第二电离能相对较小。 sp3 NH3![]() AsH3
AsH3![]() PH3 NH3分子间有氢键,AsH3和PH3结构相似,而AsH3的相对分子质量大于PH3的相对分子质量,所以分子间作用力AsH3大于PH3 体心立方 68
PH3 NH3分子间有氢键,AsH3和PH3结构相似,而AsH3的相对分子质量大于PH3的相对分子质量,所以分子间作用力AsH3大于PH3 体心立方 68![]()
![]() a 5a3ρNA
a 5a3ρNA![]()
【解析】
(1)根据钛原子电子排布分析其价电子排布式,依据沸点判断晶体类型;
(2)根据轨道中电子处于全满、全空、半满时较稳定,再失去电子需要的能量较大来分析;
(3)与As同主族的短周期元素是N、P,所以AsH3的结构应与NH3相似,NH3分子之间有氢键,沸点较高;
(4)由图1可以看出铬晶胞属于体心立方堆积,设晶胞参数(晶胞边长)为anm,则晶胞体积为a3,铬原子半径为:![]() a,根据均摊原则晶胞中含有铬原子数为8
a,根据均摊原则晶胞中含有铬原子数为8![]() 1/8
1/8![]() 1=2,故铬原子体积为:
1=2,故铬原子体积为:![]() (
(![]() a)3
a)3![]() 2,进而求算该晶胞中原子的体积占晶胞体积的百分率;
2,进而求算该晶胞中原子的体积占晶胞体积的百分率;
(5)根据晶胞结构,计算晶胞的体积,依据密度计算摩尔质量 。
(1)根据钛原子电子排布式可知,钛原子的价电子排布式为:3d24s2,由于TiCl4的熔、沸点较低,所以应为分子晶体;
本题答案为:3d24s2, 分子。
(2)气态Cu失去一个电子变成结构为[Ar]3d10的Cu+,能量较低,而Cu的第二电离能相对较大(或气态Zn失去一个电子变成结构为[Ar]3d104s1的Zn+,易再失去一个电子,所以Zn的第二电离能相对较小)。
本题答案为:气态Cu失去一个电子变成结构为[Ar]3d10的Cu+,此时3d轨道处于全满的稳定状态,所以Cu的第二电离能相对较大,而气态Zn失去一个电子变成结构为[Ar]3d104s1的Zn+,易再失去一个电子,所以Zn的第二电离能相对较小。
(3)氨分子中氮原子按sp3方式杂化,N与As同主族,所经AsH3的结构应与NH3相似,AsH3中心原子杂化的类型为sp3,NH3分子之间有氢键,沸点较高,所以一定压强下将AsH3和NH3.PH3的混合气体降温时首先液化的是NH3,由于AsH3和PH3均为分子晶体,AsH3的相对分子质量大于PH3的相对分子质量,所以分子间作用力AsH3大于PH3,故一定压强下将AsH3、NH3和PH3的混合气体降温时液化顺序是:NH3![]() AsH3
AsH3![]() PH3;
PH3;
本题答案为:sp3、NH3![]() AsH3
AsH3![]() PH3、NH3分子间有氢键,AsH3和PH3结构相似,而AsH3的相对分子质量大于PH3的相对分子质量,所以分子间作用力AsH3大于PH3。
PH3、NH3分子间有氢键,AsH3和PH3结构相似,而AsH3的相对分子质量大于PH3的相对分子质量,所以分子间作用力AsH3大于PH3。
(4)由图1可以看出铬晶胞属于体心立方堆积,设晶胞参数(晶胞边长)为anm,则晶胞体积为a3,铬原子半径为:![]() a,根据均摊原则晶胞中含有铬原子数为8
a,根据均摊原则晶胞中含有铬原子数为8![]() 1/8
1/8![]() 1=2,故铬原子体积为:
1=2,故铬原子体积为:![]() (
(![]() a)3
a)3![]() 2,所以该晶胞中原子的体积占晶胞体积的百分率为:[
2,所以该晶胞中原子的体积占晶胞体积的百分率为:[![]() (
(![]() a)3
a)3![]() 2]/ a3=68
2]/ a3=68![]() ;
;
本题答案为:体心立方,68![]() 。
。
(5)根据晶胞结构,在晶胞中含有钴原子数为8![]() 1/8
1/8![]() 1=2,晶胞边长为anm=a
1=2,晶胞边长为anm=a![]() cm,晶胞体积V=
cm,晶胞体积V=![]() ,由晶胞的边长可求面对角线及体对角线,体对角线的长度是钴原子半径的4倍,钴原子半径为:
,由晶胞的边长可求面对角线及体对角线,体对角线的长度是钴原子半径的4倍,钴原子半径为:![]() anm,设钴的相对原子质量为M,则1mol钴的质量为2M g,ρ=
anm,设钴的相对原子质量为M,则1mol钴的质量为2M g,ρ=![]() =2M/(NA
=2M/(NA![]() V),M=5a3ρNA
V),M=5a3ρNA![]() ;
;
本题答案为:![]() a 、5a3ρNA
a 、5a3ρNA![]() 。
。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】甲~庚等元素在周期表中的相对位置如下表,己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是( )
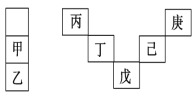
A.丙与戊的原子序数相差18
B.气态氢化物的稳定性:庚<己<戊
C.常温下,甲和乙的单质均能与水剧烈反应
D.丁的最高价氧化物可用于制造光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修5:有机化学基础]
利用化学方法合成味精的路线如下图所示:
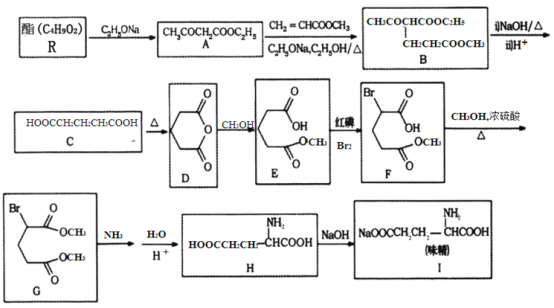
请回答以下问题:
(1)R的结构简式为________;由A生成B的反应类型是________。
(2)F中含氧官能团的名称为________;化合物H的化学名称为________________。
(3)写出由C生成D的化学方程式________________。
(4)写出一种符合下列要求的A的同分异构体的结构简式________。
①结构中含有六元环,光谱测定显示,分子结构中不存在甲基;
②能在NaOH溶液中发生水解反应;
③1mol该物质与足量金属Na反应能够生成0.5mol H2
(5)参照上述合成路线,写出以苯丙酸(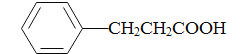 )和甲醇(其它无机试剂任选),设计合成苯丙氨酸(
)和甲醇(其它无机试剂任选),设计合成苯丙氨酸(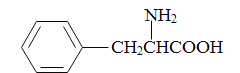 )的路线。_______________________________________________________________________
)的路线。_______________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中字母分别表示一种元素。请回答下列问题:
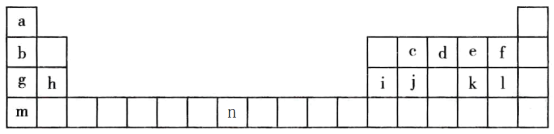
(1)a的三种核素分别为______、______、______。(用汉字表示)
(2)j是一种良好的____________材料,写出元素j的氧化物的一种用途____________。
(3)a、d、f、g四种元素的原子半径由小到大的顺序为________(用元素名称表示)。
(4)c、d、j、l四种元素最高价氧化物对应的水化物的酸性由强到弱的顺序为______(用化学式表示)。
(5)上述元素形成的氢化物中最稳定的是_____,溶于水显碱性的是_____。
(6)e、k 两种元素得电子能力强的是_____ (用元素符号表示)
(7)元素g、e 形成的原子个数1:1的化合物的化学式为_____,阴阳离子个数比为为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学对化学反应提出了“原子经济性”(原子节约) 新概念及要求。理想的原子经济性反应是原料分子中的原子全部转变成所需产物,不产生副产物,实现零排放。下列反应符合“原子经济性”要求的是( )
A.乙醇与氧气在银的催化作用下反应制备乙醛
B.乙烷与氯气反应制备氯乙烷
C.以苯和乙烯为原料,在一定条件下反应生产乙苯
D.乙醇与浓硫酸共热制备乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是地球上组成生命的最基本的元素之一,是形成单质及其化合物种类最多的元素。
(1)碳原子核外有________种不同空间运动状态的电子。
(2)碳元素能形成多种无机物。
①CO![]() 的立体构型是______________与其互为等电子体的阴离子_________________。
的立体构型是______________与其互为等电子体的阴离子_________________。
②MgCO3分解温度比CaCO3低的原因是_________________________。
(3)碳能与氢、氮、氧三种元素构成化合物CO(NH2)2,该分子中各元素的电负性由大到小的顺序为________,其中C原子的杂化方式为_______,该物质易溶于水的主要原因是________________。
(4)CO是碳元素的常见氧化物,与N2互为等电子体,则CO的结构式为________
(5)图为碳的另一种同素异形体金刚石的晶胞,其中原子坐标参数为A(0,0,0),B![]() ,C
,C![]() ;则D原子的坐标参数为________。
;则D原子的坐标参数为________。
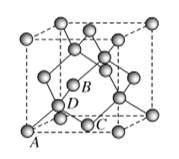
(6)立方氮化硼晶体的结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5 pm。立方氮化硼的密度是________ g·cm-3(列出计算式即可,阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,反应原理为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:
2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:
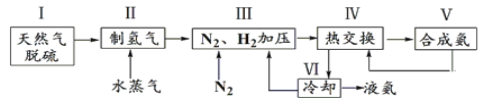
(1)①步骤Ⅱ中制氢气的原理如下:
a.CH4(g)+H2O(g)![]() CO(g)+3H2(g);K1
CO(g)+3H2(g);K1
b.CO(g)+H2O(g)![]() CO2(g)+H2(g);K2
CO2(g)+H2(g);K2
则反应CH4(g)+2H2O(g)![]() CO2(g)+4H2(g);K=___________(用含K1、K2的代数式表示)。
CO2(g)+4H2(g);K=___________(用含K1、K2的代数式表示)。
②T1温度时,对于反应:CO(g)+ H2O(g)![]() CO2(g)+ H2(g),向2 L的恒容密闭容器中通入一定量的CO和H2O(g)。若达到平衡后,反应放热Q kJ,保持其他条件不变,只是向原平衡体系中再通入0.20 mol H2O(g),则下列说法正确的是_____________。
CO2(g)+ H2(g),向2 L的恒容密闭容器中通入一定量的CO和H2O(g)。若达到平衡后,反应放热Q kJ,保持其他条件不变,只是向原平衡体系中再通入0.20 mol H2O(g),则下列说法正确的是_____________。
a.CO的转化率将增大 b.达到新平衡时的反应热ΔH > —Q
c.气体的密度将不变 d.H2O的体积分数增大
(2)将3 molH2和2 molN2充入某恒温恒压容器中,发生合成氨的反应:3H2(g) +N2(g) ![]() 2NH3(g),达平衡时NH3的浓度为c mol·L-1。保持温度不变,按下列配比分别充入该容器,平衡后NH3的浓度不为c mol·L-1的是_________。
2NH3(g),达平衡时NH3的浓度为c mol·L-1。保持温度不变,按下列配比分别充入该容器,平衡后NH3的浓度不为c mol·L-1的是_________。
a.6 molH2 + 4 molN2
b.0.75 molH2 + 0.75 molN2 + 0.5 molNH3
c.3 molH2+ 1 molN2 + 2 mol NH3
(3)H2O2作为氧化剂在反应时不产生污染物被称为绿色氧化剂,因而受到人们越来越多的关注。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答下列问题:
①定性图甲可通过观察产生气泡的快慢的定性分析比较得出结论。有同学提出将FeCl3溶液改为Fe2(SO4)3溶液,你认为___________,(填合理或不合理)
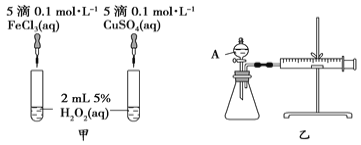
②定量如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。检查该装置气密性的方法是:关闭A的活塞,将注射器活塞向外拉出一段后松手,过一段时间后看__________,实验中需要测量的数据是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2 L的密闭容器中,加入1mol X(g)和2 mol Y(g)发生反应:X(g)+mY(g)![]() 3Z(g) ΔH<0,平衡时,X和Y的转化率都是10%。下列叙述不正确的是
3Z(g) ΔH<0,平衡时,X和Y的转化率都是10%。下列叙述不正确的是
A.m=2
B.达平衡时,Z的体积分数为10%
C.达平衡后,保持容器体积不变,加热,容器内压强将增大
D.将平衡后的容器体积压缩至1L,X的浓度为0.45mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,D是具有果香气味的烃的衍生物.A、B、C、D在一定条件下存在如下转化关系![]() 部分反应条件、产物被省略
部分反应条件、产物被省略![]() .
.
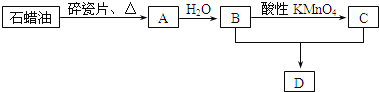
(1)工业上,由石油获得石蜡油的方法是______,由石蜡油获得A是______![]() 填“物理”或“化学”
填“物理”或“化学”![]() 变化.
变化.
(2)![]() 的化学式是______;
的化学式是______;![]() 的反应类型是______反应;写出反应
的反应类型是______反应;写出反应![]() 的化学方程式:______
的化学方程式:______
(3)丁烷是由石蜡油获得A的过程中的中间产物之一,写出它的两种同分异构体的结构简式:______、______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com