
【题目】石油是一种重要的资源。A~F是常见有机物,它们之间的转化关系如图1所示(部分产物和反应条件已略去),其中A的产量可以用来衡量一个国家的石油化工发展水平,E是最简单的芳香烃。回答下列问题:

(1)步骤②所用试剂X为___________(写化学式),D的官能团名称是_______;
(2)F的结构简式为________________,步骤①的反应类型:___________;
(3)写出下列步骤中的化学方程式(注明反应条件):
步骤③_____________________________________;
步骤④_______________________________________;
(4)用图2所示实验装置制取乙酸乙酯。请回答:试管b中所装溶液应为_____,乙酸乙酯生成后,分离出产品时的操作方法是______。
【答案】H2O 羧基 ![]() 取代反应 2CH3CH2OH+O2
取代反应 2CH3CH2OH+O2![]() 2CH3CHO+2H2O CH3COOH+CH3CH2OH
2CH3CHO+2H2O CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O 饱和碳酸钠溶液 分液
CH3COOCH2CH3+H2O 饱和碳酸钠溶液 分液
【解析】
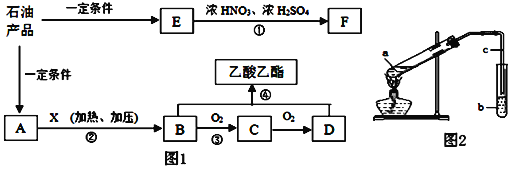 A的产量可以用来衡量一个国家的石油化工发展水平,A为CH2=CH2,A和X反应生成B,B能连续被氧化生成D,B、D发生酯化反应生成乙酸乙酯,则B为CH3CH2OH、C为CH3CHO,D为CH3COOH,则X为H2O;E是最简单的芳香烃,则E为
A的产量可以用来衡量一个国家的石油化工发展水平,A为CH2=CH2,A和X反应生成B,B能连续被氧化生成D,B、D发生酯化反应生成乙酸乙酯,则B为CH3CH2OH、C为CH3CHO,D为CH3COOH,则X为H2O;E是最简单的芳香烃,则E为![]() ,E发生取代反应生成F为
,E发生取代反应生成F为![]() ,据此分析解答。
,据此分析解答。
(1)通过以上分析知,步骤②所用试剂X为H2O,D为乙酸,D的官能团为羧基,故答案为:H2O;羧基;
(2)F的结构简式为![]() ,步骤①为苯和浓硝酸的硝化反应,也是取代反应,故答案为:
,步骤①为苯和浓硝酸的硝化反应,也是取代反应,故答案为:![]() ;取代反应(或硝化反应);
;取代反应(或硝化反应);
(3)步骤③为乙醇的催化氧化反应,反应的化学方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O;步骤④为乙醇和乙酸的酯化反应,反应的化学方程式为CH3COOH+CH3CH2OH
2CH3CHO+2H2O;步骤④为乙醇和乙酸的酯化反应,反应的化学方程式为CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O,故答案为:2CH3CH2OH+O2
CH3COOCH2CH3+H2O,故答案为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O;CH3COOH+CH3CH2OH
2CH3CHO+2H2O;CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
(4)试管b中所装溶液为饱和碳酸钠溶液,碳酸钠溶液可以溶解乙醇、可以和乙酸反应生成可溶性的乙酸钠、同时抑制乙酸乙酯的溶解,使乙酸乙酯和水不互溶,所以乙酸乙酯生成后,分离出产品时的操作方法是分液,故答案为:饱和碳酸钠溶液;分液。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】某密闭容器中发生如下反应:X(g)+3Y(g)![]() 2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是 ( )
2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是 ( )

A.t5时增大了压强
B.t3时降低了温度
C.t2时加入了催化剂
D.t4~t5时间内X或Y转化率一定最低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应X+Y=M+N的能量变化关系如图。下列关于该反应的说法中,正确的是( )
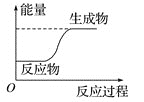
A.断裂X、Y的化学键所吸收的能量小于形成M、N的化学键所放出的能量
B.X、Y的总能量一定低于M、N的总能量
C.因为该反应为吸热反应,故一定要加热才可发生
D.X的能量一定低于M的,Y的能量一定低于N的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】另一兴趣小组的同学开展了测定Na2CO3和NaCl的固体混合物中Na2CO3质量分数的探究实验。他们设计了如下的实验方案:

(1)“操作1”的名称是___________,写出反应的离子方程式______________________。
(2)滴加CaCl2溶液应“过量”,否则可能会使测定的结果________(填“偏大”或“偏小”),确定CaCl2溶液是否过量的方法是____________________________。
(3)该混合物中Na2CO3的质量分数为___________________ (保留三位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某碳酸钠和碳酸氢钠的混合溶液中逐滴加入稀盐酸,加入稀盐酸的体积与标准状况下产生气体体积的关系如图所示。
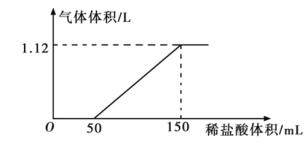
(1)生成![]() 气体的物质的量是多少?________________。
气体的物质的量是多少?________________。
(2)盐酸的物质的量浓度是多少?_____________。
(3)原溶液中碳酸钠与碳酸氢钠的物质的量之比是多少?_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值.下列有关叙述正确的是( )
A. l mol OH﹣所含电子数为10NA
B. 2L0.5 molL﹣1Na2SO4溶液中阴离子所带电荷数为0.2NA
C. 标准状况下,1.12 L CC14含有的氯原子数为0.2NA
D. 14 g由CO和N2组成的混合气体中含有的分子总数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与 的变化关系
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S常用作皮革脱毛剂,工业上用反应Na2SO4 +2C ![]() Na2S+2CO2↑ 进行制取。
Na2S+2CO2↑ 进行制取。
(1)上述反应中涉及的各元素中原子半径最小的是_______(填元素符号),该原子有_____种不同能量的电子。
(2)羰基硫的化学式为COS,结构和CO2 相似,请写出COS的电子式_________,判断羰基硫分子属于________(选填“极性”或“非极性”)分子。
(3)写出一个能比较S和O非金属性强弱的化学事实_____________________ ;请从原子结构解释原因_____________________________。
(4)将Na2S溶液滴入AlCl3溶液中,产生白色沉淀,同时有臭鸡蛋气味的气体生成,用平衡移动原理解释上述现象__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是
A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ·mol-1
B.由N2(g)+3H2(g)![]() 2NH3(g)△H=-92.4 kJ·mol-1热化学方程式可知, 当反应中转移6NA电子时,反应放出的热小于92.4 kJ
2NH3(g)△H=-92.4 kJ·mol-1热化学方程式可知, 当反应中转移6NA电子时,反应放出的热小于92.4 kJ
C.HCl和NaOH反应的中和热△H=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ·mol-1
D.在101 kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H=-571.6 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com