
【题目】下列反应不需要加热就能进行的吸热反应是( )
A.碳酸钙分解
B.甲烷在氧气中燃烧
C.灼热的炭与二氧化碳反应
D.Ba(OH)28H2O与NH4Cl反应
科目:高中化学 来源: 题型:
【题目】常温下,将甲酸和氢氧化钠溶液混合,所得溶液pH=7,则此溶液中( )
A. c(HCOO-)>c(Na+) B. c(HCOO-)<c(Na+)
C. c(HCOO-)=c(Na+) D. 无法确定c(HCOO-)与c(Na+)的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化石墨烯(结构如图所示)是一种性能优异的新型碳材料。实验室制备氧化石墨烯的一种方法如下:

(1)将浓硫酸“冷却至0℃”可采用的方法是 。
(2) 步骤②采用100目鳞片状的石墨,其主要目的是 ;图示的“搅拌”方式为 。
(3)步骤③④中加NaNO3和KMnO4的作用是 。
(4)步骤⑧H2O2还原剩余的KMnO4反应的离子方程式为 ;检验洗涤已无SO42-的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。已知:①CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH=-296.0 kJ·mol-1
此反应的热化学方程式是________________________________。
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
若用标准状况下3.36 L CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为____________mol,放出的热量为____________kJ(用含有a和b的代数式表示)。
(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH1=-574 kJ·mol-1①
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=?②
若1 mol CH4还原NO2至N2,整个过程中放出的热量为867 kJ,则ΔH2=____________。
(4)某氮肥厂氨氮废水中的氮元素多以NH![]() 和NH3·H2O形式存在,该废水的处理流程中,NH
和NH3·H2O形式存在,该废水的处理流程中,NH![]() 在微生物作用的条件下经过两步反应被氧化成NO
在微生物作用的条件下经过两步反应被氧化成NO![]() 。两步反应的能量变化示意如图所示:
。两步反应的能量变化示意如图所示:
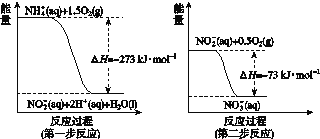
1 mol NH![]() (aq)全部氧化成NO
(aq)全部氧化成NO![]() (aq)的热化学方程式是________________。
(aq)的热化学方程式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学--选修物质结构与性质】
信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门。
信息二:氯化铬酰(CrO2Cl2)是铬的一种化合物,常温下该化合物是暗红色液体,熔点为﹣96.5℃,沸点为117℃,能和丙酮(CH3COCH3)、四氯化碳、CS2等有机溶剂互溶。
(1)写出Fe(26号元素)原子的基态电子排布式为 。
(2)CH3COCH3分子中含有 个π键,含有 个δ键。
(3)固态氯化铬酰属于 晶体,丙酮中碳原子的杂化方式为 ,二硫化碳属于 (填极性”或“非极性”)分子。
(4)K[Cr(C2O4)2(H2O)2]也是铬的一种化合物,该化合物属于离子化合物,其中除含离子键、共价键外,还含有有 键。
(5)金属铬的晶胞如下图所示,一个晶胞中含有 个铬原子。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①某NaCl样品中可能含有SO42-、CO32-,为检验杂质离子的存在,采取如下实验步骤:
样品![]() 无明显现象
无明显现象![]() 无明显现象。
无明显现象。
则加入的试剂A为 ,B为 (填化学式),该现象证明样品中不含有 。
②在后续实验中需要使用450mL0.5 mol·L-1NaCl溶液,为配制该浓度NaCl溶液进行实验,需用托盘天平称取NaCl g。
③配制NaCl溶液时,若出现下列操作,会使配制浓度偏高的是( )
A.称量时NaCl已潮解 |
B.天平砝码已锈蚀 |
C.定容时俯视刻度线 |
D.定容摇匀后液面下降,又加水至刻度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中发生如下反应:A(g)+3B(g)![]() 2C(g) ΔH<0,根据下列速率—时间图像,回答下列问题。
2C(g) ΔH<0,根据下列速率—时间图像,回答下列问题。
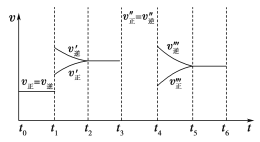
(1)下列时刻所改变的外界条件是:
t1________;t3________;t4________;
(2)物质A的体积分数最大的时间段是________________;
(3)上述图像中C的体积分数相等的时间段是________________;
(4)反应速率最大的时间段是________________。
(5)t0~t1、t3~t4、t5~t6时间段的平衡常数K0、K3、K5的关系________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com