
【题目】密闭容器中发生如下反应:A(g)+3B(g)![]() 2C(g) ΔH<0,根据下列速率—时间图像,回答下列问题。
2C(g) ΔH<0,根据下列速率—时间图像,回答下列问题。
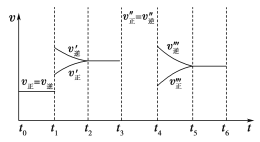
(1)下列时刻所改变的外界条件是:
t1________;t3________;t4________;
(2)物质A的体积分数最大的时间段是________________;
(3)上述图像中C的体积分数相等的时间段是________________;
(4)反应速率最大的时间段是________________。
(5)t0~t1、t3~t4、t5~t6时间段的平衡常数K0、K3、K5的关系________________
【答案】(1)t1 升高温度 ;t3 使用催化剂 ;t4 减小压强 ;
(2)t5-t6;(3)t2-t3,t3-t4;(4)t3-t4(5)K0〉K3=K5
【解析】
试题分析:(1)t1时,正逆反应速率都增大,且逆反应速率大于正反应速率,反应向逆反应方向移动,则应为升高温度;t3时,正逆反应速率都增大,正逆反应速率相等,平衡不移动,应为加入催化剂;t4时,正逆反应速率都减小,且逆反应速率大于正反应速率,平衡向逆反应方向移动,由方程式计量数关系可知,应为减小压强。
(2)t1~t2,t4~t5,反应向逆反应方向移动,随着反应的进行,生成的A逐渐增多,A的体积分数逐渐增大,所以A的体积分数最大的时间段是t5-t6 ;
(3)根据上述分析,t2~t3,t3~t4,平衡不移动,C的体积分数相等,答案为t2-t3,t3-t4 ;
(4)根据改变的条件,t1时升高温度反应速率增大,t3时加入催化剂反应速率增大,t4时减小压强反应速率减小,所以反应速率最大的时间段是t3~t4;
(5)温度不变,平衡常数不变,该反应为放热反应,温度升高,平衡常数减小, t1时升高温度,平衡常数减小,t0~t1、t3~t4、t5~t6时间段的平衡常数K0、K3、K5的关系为K0〉K3=K5。


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】下列反应不需要加热就能进行的吸热反应是( )
A.碳酸钙分解
B.甲烷在氧气中燃烧
C.灼热的炭与二氧化碳反应
D.Ba(OH)28H2O与NH4Cl反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A.HCl和NaOH反应的中和热ΔH=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的反应热ΔH=2×(-57.3) kJ/mol
B.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)===2CO(g)+O2(g)反应的ΔH=+566.0 kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下进行反应:COCl2(g)![]() Cl2(g)+CO(g)。向2.0 L恒容密闭容器中充入1.0 mol COCl2(g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:
Cl2(g)+CO(g)。向2.0 L恒容密闭容器中充入1.0 mol COCl2(g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
下列说法正确的是( )
A.保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol·L-1,则反应的ΔH<0
B.若在2 L恒容绝热(与外界没有热量交换)密闭容器进行该反应,化学平衡常数不变
C.保持其他条件不变,起始向容器中充入1.2 mol COCl2、0.60 mol Cl2和0.60 mol CO,反应达到平衡前的速率:v(正)>v(逆)
D.保持其他条件不变,起始向容器中充入1.0 mol Cl2和0.8 mol CO,达到平衡时,Cl2的转化率小于60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NO2装入带活塞的密闭容器中,当反应2NO2(g)![]() N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是
N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是
A、升高温度,气体颜色加深,则此反应为吸热反应
B、慢慢压缩气体体积,平衡向右移动,混合气体颜色变浅
C、慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D、恒温恒容时,充入少量惰性气体,压强增大,平衡向右移动,混合气体的颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要配制0.55mol·L-1NaOH溶液220mL。按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平、药匙、烧杯、玻璃棒、。
(2)计算。配制该溶液需取NaOH晶体。
(3)称量。
①天平调平后,应将天平的游码调至某个位置,请在下图中用一根竖线标出游码左边缘所处的位置:![]() (1g以下用游码):
(1g以下用游码):
②称量过程中NaOH晶体应放于天平的(填“左盘”或“右盘”)。
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是 。
(5)转移、洗涤。在转移时应使用玻璃棒引流,应注意;需要洗涤烧杯2~3次是为了 。
(6)定容、摇匀。
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,贴好标签,注明溶液名称、浓度及配制的时间。
(8)下列操作使所配溶液浓度偏大的有(填字母,下同);无影响的有。
A.称量时用生锈的砝码 |
B.将NaOH放在纸上称量 |
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中 |
D.往容量瓶转移时有少量液体溅出 |
E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线
G.容量瓶未干燥就用来配制溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),下列分析推理正确的是
50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
m(混合物) | 9.2g | 15.7g | 27.6g |
| 2.24L | 3.36L | 3.36L |
A.盐酸的物质的量浓度为5.0mol·L-1
B.根据表中数据计算出混合物中NaHCO3的物质的量分数为50%
C.9.2g混合物中NaHCO3和KHCO3分别为5.0g和4.2g
D.15.7g混合物恰好与盐酸完全反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com