
分析 (1)若A为CH3COOH,Q中CH3COOH和CH3COONa物质的量浓度相等,溶液呈酸性说明CH3COOH的电离程度大于CH3COO-的水解程度;
若A为HCl,则Q中c(H+)=0.01 mol•L-1,根据Kw计算;
若A为H2S,则Q中NaHS与H2S的物质的量浓度相等,Q接近中性,说明HS-的水解能力较强;
(2)根据电荷守恒分析;
(3)碱与三种酸等物质的量混合后,所得到的溶液分别呈中性、碱性、碱性,又因酸性:CH3COOH>H2S,故三种酸形成的盐溶液的pH大小顺序为NaCl<CH3COONa<NaHS,当所得的盐为中性时,表明碱与弱酸反应时酸略有过量,且酸性越弱,酸应过量得越多.
解答 解:(1)若A为CH3COOH,Q中CH3COOH和CH3COONa物质的量浓度相等,溶液呈酸性说明CH3COOH的电离程度大于CH3COO-的水解程度,离子浓度的大小顺序为c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
若A为HCl,则Q中c(H+)=0.01 mol•L-1,100℃时KW=10-12,则c(OH-)=10-10 mol•L-1,水电离生成的H+物质的量等于OH-的物质的量,因此水电离出的H+浓度为10-10 mol•L-1;
若A为H2S,则Q中NaHS与H2S的物质的量浓度相等,若HS-的电离能力强于或等于其水解能力,则溶液一定呈酸性,而实际上Q接近中性,说明HS-的水解能力较强,所以HS-的电离能力<水解能力;
故答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-);10-10;<;
(2)由电荷守恒,①中有c(Na+)+c(H+)=c(HS-)+c(OH-)+2c(S2-)>c(HS-)+c(OH-)+c(S2-),②中有c(Na+)+c(H+)=c(CH3COO-)+c(OH-),③中有c(Na+)+c(H+)=c(Cl-)+c(OH-),三种溶液中的c(Na+)相等,但c(H+):③>②>①,所以三种溶液中阴离子浓度的大小顺序为③>②>①;
故答案为:③>②>①;
(3)碱与三种酸等物质的量混合后,所得到的溶液分别呈中性、碱性、碱性,又因酸性:CH3COOH>H2S,故三种溶液的pH大小顺序为NaCl<CH3COONa<NaHS,当所得的盐为中性时,表明碱与弱酸反应时酸略有过量,且酸性越弱,酸应过量得越多,故a>b>c;
故答案为:a>b>c.
点评 本题考查了弱电解质的电离、离子浓度大小的比较、盐类水解等知识点,明确弱电解质的电离特点、盐类水解特点结合电荷守恒来分析解答,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| B. | 氧的原子结构示意图: | |
| C. | NaCl的电子式: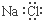 | |
| D. | 质量数为37的氯原子:${\;}_{34}^{17}$Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30% | B. | 20% | C. | 40% | D. | 35% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
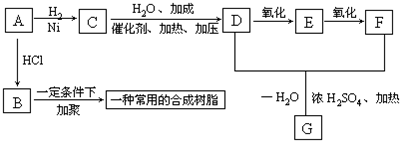
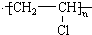 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式为CH2CH2 | B. | 烃类分子中可能含有氧元素 | ||
| C. | 化学用语:乙酸乙脂笨 | D. | 烷烃的通式为CnH2n+2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | Z | |
| A | FeCl2溶液 | FeCl3 | KSCN溶液 |
| B | Fe粉 | A1粉 | HC1溶液 |
| C | Fe2(SO4)3溶液 | FeSO4 | C12 |
| D | FeCl2溶液 | CuCl2 | Fe粉 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com