
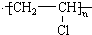 .
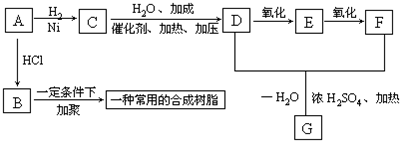
.分析 A是乙炔,1mol A与1mol HCl加成可得到B,则B为CH2=CHCl;1mol A与1mol H2加成可得到C,C为CH2=CH2,C发生加成反应生成D为CH3CH2OH,B发生加聚反应生成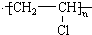 ,D发生氧化反应生成E,E能发生氧化反应生成F,D和F发生酯化反应生成G,则E为CH3CHO、F为CH3COOH、G为CH3COOCH2CH3,结合题目分析解答.
,D发生氧化反应生成E,E能发生氧化反应生成F,D和F发生酯化反应生成G,则E为CH3CHO、F为CH3COOH、G为CH3COOCH2CH3,结合题目分析解答.
解答 解:A是乙炔,1mol A与1mol HCl加成可得到B,则B为CH2=CHCl;1mol A与1mol H2加成可得到C,C为CH2=CH2,C发生加成反应生成D为CH3CH2OH,B发生加聚反应生成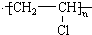 ,D发生氧化反应生成E,E能发生氧化反应生成F,D和F发生酯化反应生成G,则E为CH3CHO、F为CH3COOH、G为CH3COOCH2CH3,
,D发生氧化反应生成E,E能发生氧化反应生成F,D和F发生酯化反应生成G,则E为CH3CHO、F为CH3COOH、G为CH3COOCH2CH3,
(1)实验室用碳化钙和水反应制取乙炔,反应方程式为CaC2+H2O→Ca(OH)2+CH≡CH↑
,故答案为:CaC2+H2O→Ca(OH)2+CH≡CH↑;
(2)通过以上分析知,B为氯乙烯,氯乙烯发生加聚反应生成聚氯乙烯,方程式为nCH2=CHCl $\stackrel{一定条件下}{→}$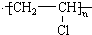 ,
,
故答案为:氯乙烯;nCH2=CHCl $\stackrel{一定条件下}{→}$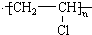 ;
;
(3)在Ni作催化剂条件下,乙炔和氢气发生加成反应生成乙烯,反应方程式为CH≡CH+H2$\stackrel{Ni}{→}$CH2=CH2,故答案为:CH≡CH+H2$\stackrel{Ni}{→}$CH2=CH2;加成反应;
(4)乙醇发生催化氧化反应生成乙醛,反应方程式为2C2H5OH+O2$→_{△}^{Cu或Ag}$2CH3CHO+2H2O
,
故答案为:2C2H5OH+O2$→_{△}^{Cu或Ag}$2CH3CHO+2H2O;
(5)G为乙酸乙酯,其结构简式为CH3COOC2H5,故答案为:CH3COOC2H5.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,明确官能团及其性质关系、物质之间的转化是解本题关键,注意(4)题方程式的配平,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 浓H2SO4溅到皮肤上,立即涂3%~5%的NaHCO3溶液,再用大量水冲洗 | |
| B. | 温度计打破,水银洒在桌上,立即用硫粉覆盖 | |
| C. | 在实验中不慎手被玻璃划破,可用碘酒或双氧水清洗后,再用药外敷 | |
| D. | 不慎将酸溅到眼中,应立即用水清洗,边洗边眨眼 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④① | B. | ④②③① | C. | ④①②③ | D. | ③④①② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+,CO32-,Cl-,Na+ | B. | Al3+,NH4+,OH-,NO3- | ||
| C. | Ag+,Br-,SO42-,K+ | D. | NO3-,Na+,H+,Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
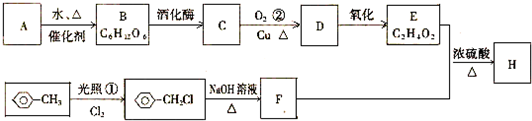
 ,
,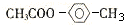 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
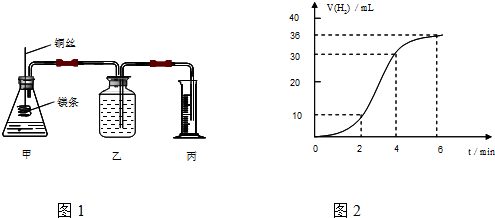
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- | |
| B. | 用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| C. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| D. | 碳酸钙与醋酸溶液反应:CaCO3+2H+═Ca2++CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com