
| A. | 1 mol H2 | B. | 0.5molNH3 | ||
| C. | 6.02×1023个的CH4分子 | D. | 29.4gH3PO4 |
分析 根据n=$\frac{N}{{N}_{A}}$=$\frac{m}{M}$结合物质的分子构成计算.
解答 解:由N=nNA可知,氢原子的物质的量越多,原子个数越多,
A.1 mol H2含有2molH;
B.0.5molNH3含有1.5molH;
C.6.02×1023个的CH4的物质的量为1mol,含有4molH;
D.29.4gH3PO4的物质的量为$\frac{29.4g}{98g/mol}$=0.3mol,0.3molH3PO4含有0.9mol,
则氢原子个数最多的为C,
故选C.
点评 本题考查物质的量的计算,侧重于学生的分析能力的考查,注意把握相关计算公式的运用,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
 恒温密闭容器发生可逆反应:Z(?)+W(?)?X(g)+Y(?);△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中正确的是( )
恒温密闭容器发生可逆反应:Z(?)+W(?)?X(g)+Y(?);△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中正确的是( )| A. | t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等 | |
| B. | Z和W在该条件下都不为气态 | |
| C. | 若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度不相等 | |
| D. | 若该反应只在某温度T0以上才能进行,则该反应的平衡常数K随温度升高而减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铂丝蘸取某未知溶液于酒精灯火焰上灼烧,显黄色,证明该溶液不含K+ | |
| B. | 萃取碘水中的碘时,可以选择苯或四氯化碳作为萃取剂 | |
| C. | 某溶液中先加氯水,再滴加KSCN溶液出现血红色,证明溶液中含有Fe2+ | |
| D. | 某无色溶液中加硝酸银溶液产生白色沉淀,再加稀盐酸沉淀不消失,证明原溶液中含有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
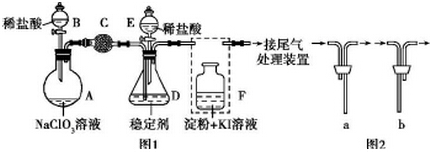
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnO2→MnO4- | B. | Al(OH)4-→Al(OH)3 | C. | SO32-→SO42- | D. | MnO2→MnCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量的铁与稀H2SO4反应 | B. | FeO与H2SO4反应 | ||
| C. | FeCO3与H2SO4稀反应 | D. | Fe(OH)3与稀H2SO4反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
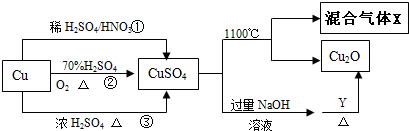
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com