
【题目】七铝十二钙(12CaO·7Al2O3)是新型的超导材料和发光材料。用白云石(主要含CaCO3和MgCO3)和废Al片制备七铝十二钙的工艺如下:
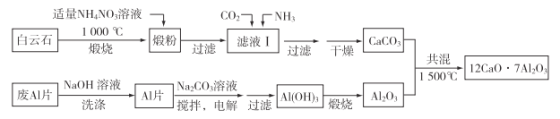
(1)煅粉主要含MgO和____________,用适量NH4NO3溶液浸取煅粉后,镁化合物几乎不溶;若滤液Ⅰ中c(Mg2+)小于5×10-6 mol·L-1,则溶液pH大于________[Mg(OH)2的Ksp=5×10-12];该工艺中不能用(NH4)2SO4代替NH4NO3,原因是_________________。
(2)滤液Ⅰ中的阴离子有________(忽略杂质成分的影响);若滤液Ⅰ中仅通入CO2,会生成_________________,从而导致CaCO3产率降低。
(3)用NaOH溶液可除去废Al片表面的氧化膜,反应的离子方程式为____________。
(4)电解制备Al(OH)3时,电极分别为Al片和石墨,电解总反应方程式为____________。
(5)一种可超快充电的新型铝电池,充放电时AlCl![]() 和Al2Cl
和Al2Cl![]() 两种离子在Al电极上相互转化,其他离子不参与电极反应,放电时负极Al的电极反应式为__________________________________。
两种离子在Al电极上相互转化,其他离子不参与电极反应,放电时负极Al的电极反应式为__________________________________。
【答案】(1)CaO 11 易生成硫酸钙沉淀而导致碳酸钙产率降低
(2)NO![]() 、OH- Ca(HCO3)2
、OH- Ca(HCO3)2
(3)Al2O3+2OH-===2AlO![]() +H2O
+H2O
(4)2Al+6H2O2Al(OH)3+3H2↑
(5)Al-3e-+7AlCl![]() ===4Al2Cl
===4Al2Cl![]()
【解析】(1)碳酸钙和碳酸镁受热均易分解,生成氧化镁和氧化钙,因此另一种物质为氧化钙;根据溶度积常数可计算出氢氧根离子浓度为1×10-3mol/L,因此氢离子浓度为1×10-11mol/L,所以pH应大于11;如果用硫酸铵代替硝酸铵,钙离子与硫酸根离子能形成硫酸钙沉淀。
(2)滤液Ⅰ中的阴离子包括加入硝酸铵引入的硝酸根离子,水电离生成的氢氧根离子。如果只通入二氧化碳,可能会生成碳酸氢钙,从而导致碳酸钙的产率降低。
(3)氧化铝与氢氧化钠溶液反应的离子方程式为:Al2O3+2OH-===2AlO![]() +H2O。
+H2O。
(4)阳极上为铝失电子生成铝离子,阴极上为氢离子得电子生成氢气,其电解总反应方程式为2Al+6H2O2Al(OH)3+3H2↑。
(5)因为没有其他离子放电,因此负极反应式为Al-3e-+7AlCl![]() ===4Al2Cl
===4Al2Cl![]() 。
。


科目:高中化学 来源: 题型:
【题目】1.52 g镁铜合金完全溶解于50 mL密度为1.40 g·mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体 1 120 mL(标准状况),向反应后的溶液中加入1.0 mol·L-1NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。请完成下列问题:
(1)该合金中镁与铜的物质的量之比是 ;
(2)NO2和N2O4的混合气体中,NO2的体积分数是 ;
(3)得到2.54 g沉淀时,加入NaOH溶液的体积是 mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以磷石膏(主要成分CaSO4,杂质SiO2、Al2O3等)为原料可制备轻质CaCO3,流程图如下。
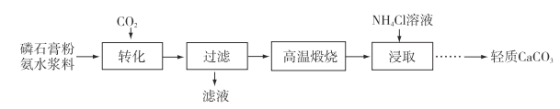
(1)匀速向浆料中通入CO2,浆料清液的pH和c(SO42-)随时间变化见如下图。清液pH>11时CaSO4转化的离子方程式为________;能提高其转化速率的措施有________(填序号)。

A.搅拌浆料
B.加热浆料至100 ℃
C.增大氨水浓度
D.减小CO2通入速率
(2)当清液pH接近6.5时,过滤并洗涤固体。滤液中物质的量浓度最大的两种阴离子为________和__________(填化学式);检验洗涤是否完全的方法是_____________________。
(3)在敞口容器中,用NH4Cl溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中c(Ca2+)增大的原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶体区别于其他分散系的本质特征是
A.胶体的分散质能通过滤纸孔隙,而浊液的分散质不能
B.胶体能产生丁达尔现象
C.胶体分散质粒子直径在1~100 nm之间
D.胶体在一定条件下能稳定存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关现象及对应的离子方程式或化学反应方程式不正确的是
A.草酸溶液可使酸性高锰酸钾溶液褪色:MnO4-+C2O42-+16H+=Mn2++2CO2↑+8H2O
B.在酸性环境中不存在 S2O32-:S2O32-+2H+=S↓+SO2↑+H2O
C.K2Cr2O7在水中存在平衡:Cr2O72-+H2O![]() 2CrO42-+2H+,可由溶液颜色判断其酸碱性
2CrO42-+2H+,可由溶液颜色判断其酸碱性
D.SOCl2是一种液态化合物,遇水有雾及刺激性气味气体产生,其化学反应方程式为
SOCl2+H2O=2HCl↑+SO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温下的六份溶液:①0.01mol/LCH3COOH溶液;②0.01mol/LHCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01mol/LCH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01mol/LHCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
⑴其中水的电离程度最大的是 (选填序号,下同),水的电离程度相同的是 ;
⑵若将②、③混合后所得溶液pH=7,则消耗溶液的体积:② ③(选填“>”、“<”或“=”);
⑶将六份溶液同等程度稀释10倍后,溶液的pH:① ②,③ ④(选填“>”、“<”或“=”);
⑷某二元酸H2A电离方程式是H2A=H++HA-、HA-![]() A2-+H+。回答下列问题:
A2-+H+。回答下列问题:
①Na2A溶液显__________性,理由是__________(用离子方程式表示).
②若0.1mol/LNaHA溶液的pH=2,则0.1mol/LH2A溶液中氢离子的物质的量浓度可能__________0.11mol/L(填“<”、“>”或“=”)理由是______________.
③0.1mol/LNaHA溶液中各离子浓度由大到小的顺序是______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 甲烷与乙烯互为同系物
B. 32S与33S是同种核素
C. 正丁烷与异丁烷互为同素异形体
D. 乙醇和二甲醚(CH3-O-CH3)互为同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com