
【题目】现有常温下的六份溶液:①0.01mol/LCH3COOH溶液;②0.01mol/LHCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01mol/LCH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01mol/LHCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
⑴其中水的电离程度最大的是 (选填序号,下同),水的电离程度相同的是 ;
⑵若将②、③混合后所得溶液pH=7,则消耗溶液的体积:② ③(选填“>”、“<”或“=”);
⑶将六份溶液同等程度稀释10倍后,溶液的pH:① ②,③ ④(选填“>”、“<”或“=”);
⑷某二元酸H2A电离方程式是H2A=H++HA-、HA-![]() A2-+H+。回答下列问题:
A2-+H+。回答下列问题:
①Na2A溶液显__________性,理由是__________(用离子方程式表示).
②若0.1mol/LNaHA溶液的pH=2,则0.1mol/LH2A溶液中氢离子的物质的量浓度可能__________0.11mol/L(填“<”、“>”或“=”)理由是______________.
③0.1mol/LNaHA溶液中各离子浓度由大到小的顺序是______________.
【答案】(1)⑥ ②③④(2)> (3)> >
(4)①碱性 A2-+H2O![]() HA-+OH-
HA-+OH-
②< H2A第一步电离产生的H+对HA-的电离起了抑制作用
③c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
【解析】
试题分析:(1)水属于弱电解质,存在电离平衡H2O![]() H++OH-,根据电离出的离子可知酸或碱抑制水的电离,而盐类的水解则促进水的电离。pH=12的氨水,说明氨水的浓度大于0.01mol/L,所以⑤中氨水是过量的,所以溶液显碱性。在⑥中二者恰好反应生成氯化钠,氯化钠是不能发生水解的,所以在该溶液中水的电离没有被抑制,而在①②③④⑤中均是抑制水的电离的,因为②③④中H+浓度或OH-的浓度均是0.01mol,所以对水的电离抑制程度是相同的。即水的电离程度最大的是⑥,水的电离程度相同的是②③④。
H++OH-,根据电离出的离子可知酸或碱抑制水的电离,而盐类的水解则促进水的电离。pH=12的氨水,说明氨水的浓度大于0.01mol/L,所以⑤中氨水是过量的,所以溶液显碱性。在⑥中二者恰好反应生成氯化钠,氯化钠是不能发生水解的,所以在该溶液中水的电离没有被抑制,而在①②③④⑤中均是抑制水的电离的,因为②③④中H+浓度或OH-的浓度均是0.01mol,所以对水的电离抑制程度是相同的。即水的电离程度最大的是⑥,水的电离程度相同的是②③④。
(2)pH=12的氨水,说明氨水的浓度大于0.01mol/L,所以②③等体积混合后氨水过量,溶液显碱性,要使溶液显中性,盐酸的体积必须大于氨水的体积。
(3)醋酸和盐酸起始浓度相同,①②稀释相同倍数后二者的浓度仍然相等,但是醋酸是弱酸,部分电离,氢离子浓度较小,pH较大,则溶液的pH:①>②;③④稀释前pH相等,但稀释后氨水继续电离,③中OH-的物质的量要大于④中的,所以溶液的pH:③>④。
(4)①根据H2A的电离是分步电离可以知道H2A是弱酸,所以Na2A溶液显碱性,水解原理是A2-+H2O ![]() HA-+OH- 。
HA-+OH- 。
②0.1molL-1H2A溶液,H2A═H++HA-,电离出0.1mol/LH+,0.1molL-1NaHA溶液的pH=2,则由HA-H++A2-可知,电离出0.01mol/LH+,但第一步电离生成的H+抑制了HA-的电离,所以溶液中氢离子的物质的量浓度小于0.1mol/L+0.01mol/L=0.11mol/L。
③NaHA溶液显酸性,存在HA-H++A2-,则c(Na+)>c(HA-)>c(H+)>c(OH-),结合水的电离H2OH++OH-,同时有部分A2-发生水解,使c(A2-)减小,所以c(H+)>c(A2-),即NaHA溶液中各种离子浓度由大到小的顺序为c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体。
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。Ba(ClO)2可溶于水。利用下图所示装置进行实验。
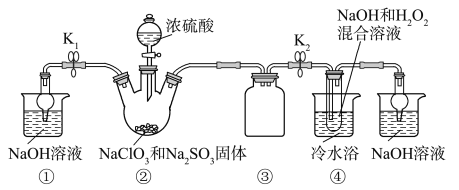
(1)装置①的作用是_______________,装置③的作用是______________________。
(2)装置②中产生ClO2气体的化学方程式为________________________。
(3)从装置④反应后的溶液获得晶体NaClO2的操作步骤为:
①减压,55 ℃蒸发结晶;
②趁热过滤;
③________________________;
④低于60 ℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。设计如下实验方案,并进行实验。
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO![]() +4I-+4H+===2H2O+2I2+Cl-)。将所得混合液配成100 mL待测溶液。
+4I-+4H+===2H2O+2I2+Cl-)。将所得混合液配成100 mL待测溶液。
②移取25.00 mL待测溶液于锥形瓶中,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(已知:I2 +2S2O![]() ===2I-+S4O
===2I-+S4O![]() )。
)。
(4)样品中NaClO2的质量分数为__________(用含m、c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】七铝十二钙(12CaO·7Al2O3)是新型的超导材料和发光材料。用白云石(主要含CaCO3和MgCO3)和废Al片制备七铝十二钙的工艺如下:
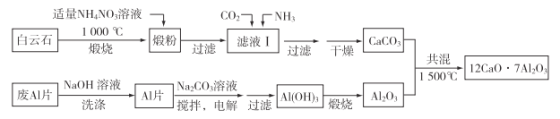
(1)煅粉主要含MgO和____________,用适量NH4NO3溶液浸取煅粉后,镁化合物几乎不溶;若滤液Ⅰ中c(Mg2+)小于5×10-6 mol·L-1,则溶液pH大于________[Mg(OH)2的Ksp=5×10-12];该工艺中不能用(NH4)2SO4代替NH4NO3,原因是_________________。
(2)滤液Ⅰ中的阴离子有________(忽略杂质成分的影响);若滤液Ⅰ中仅通入CO2,会生成_________________,从而导致CaCO3产率降低。
(3)用NaOH溶液可除去废Al片表面的氧化膜,反应的离子方程式为____________。
(4)电解制备Al(OH)3时,电极分别为Al片和石墨,电解总反应方程式为____________。
(5)一种可超快充电的新型铝电池,充放电时AlCl![]() 和Al2Cl
和Al2Cl![]() 两种离子在Al电极上相互转化,其他离子不参与电极反应,放电时负极Al的电极反应式为__________________________________。
两种离子在Al电极上相互转化,其他离子不参与电极反应,放电时负极Al的电极反应式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na 、Fe 、Cl 是中学化学常见的元素。回答下列问题:
(1)含上述元素的常见化合物中,呈淡黄色的是 (填化学式)。
(2)焰色反应的实验中,Na元素燃烧时的焰色为 色,观察 K元素燃烧时的焰色需要透过 。
(3)实验室在制备 Fe(OH)2 时必须隔绝空气,否则发生的现象是 。
(4)Mg与碳粉和氯气在一定条件下反应可制备 MgCl2,该反应的化学方程式为 。若尾气可用足量 NaOH溶液完全吸收,则生成的盐为 (写化学式)。
(5)由 NO、H2、CO2组成的混合气体,先通过足量的 Na2O2充分反应后,再将混合气体用电火花引燃,充分反应后最终只得到质量分数为 70%的硝酸,无其他气体剩余。则原混合气体中 NO、H2、CO2的体积比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Na2CO3和NaHCO3混合物灼烧至恒重,将放出的气体通入足量的澄清石灰水中,充分反应后得到的沉淀的质量是l.0g,加热后剩余的固体物质与足量的稀盐酸反应,收集到1.12L气体(标准状况).则原固体混合物中NaHCO3的物质的量为_______,Na2CO3的质量为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在学习了化学反应速率知识后,某研究性学习小组进行了科学探究活动。
[探究活动一]探究金属与不同酸反应的反应速率:常温下,用经过砂纸打磨的铝片中取两片质量相等、表面积相同的铝片,分别加入到盛有体积相同、c(H+)相同,足量的稀硫酸和稀盐酸溶液的两支试管中,发现铝片在稀盐酸中消失的时间比在稀硫酸中短。
(1)对[探究活动一]实验现象发生的原因,请你帮该研究性学习小组提出两个假设:
假设Ⅰ_______________________________。
假设Ⅱ_______________________________。
并请你设计实验对以上假设进行验证:
验证假设Ⅰ_______________________________。
验证假设Ⅱ_______________________________。
[探究活动二]某小组在实验室测定氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率。
(2)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)2NH3(g)+CO2(g).
实验测得不同温度下的平衡数据列于下表:
温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
①可以判断该分解反应已经达到化学平衡状态的是 .
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数: .
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量 (填“增加”、“减小”或“不变”).
④氨基甲酸铵分解反应的焓变△H 0,熵变△S 0(填>、<或=).
(3)已知:NH2COONH4+2H2ONH4HCO3+NH3H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如下图所示.
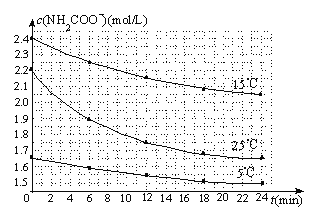
⑤计算25℃时,0~6min氨基甲酸铵水解反应的平均速率: .
⑥根据图中信息,如何说明水解反应速率随温度升高而增大: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学购买了一瓶“84消毒液”,包装说明如下:
净含量:1 000 mL 密度:1.19 g·cm-3
主要成分:25%NaClO
使用方法:稀释100倍(体积比)后使用
注意事项:密封保存,易吸收空气中的CO2变质
请根据以上信息和相关知识判断,下列分析不正确的是( )
A.该“84消毒液”的物质的量浓度约为4.0 mol·L-1
B.一瓶该“84消毒液”能吸收空气中44.8 L的CO2(标准状况)而变质
C.取100 mL该“84消毒液”稀释100倍后用以消毒,稀释后的溶液中c(Na+)约为0.04 mol·L-1
D.参阅该“84消毒液”的配方,欲用NaClO固体配制含25%NaClO的消毒液480 mL,需要称量的NaClO固体质量为143 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2015·上海]下列有关物质性质的比较,错误的是
A.溶解度:小苏打<苏打 B.密度:溴乙烷>水
C.硬度:晶体硅<金刚石 D.碳碳键键长:乙烯>苯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com