
【题目】某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体。
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。Ba(ClO)2可溶于水。利用下图所示装置进行实验。
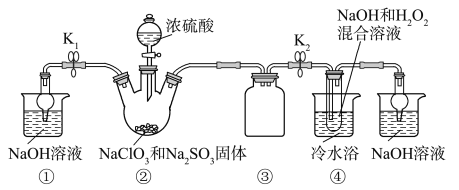
(1)装置①的作用是_______________,装置③的作用是______________________。
(2)装置②中产生ClO2气体的化学方程式为________________________。
(3)从装置④反应后的溶液获得晶体NaClO2的操作步骤为:
①减压,55 ℃蒸发结晶;
②趁热过滤;
③________________________;
④低于60 ℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。设计如下实验方案,并进行实验。
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO![]() +4I-+4H+===2H2O+2I2+Cl-)。将所得混合液配成100 mL待测溶液。
+4I-+4H+===2H2O+2I2+Cl-)。将所得混合液配成100 mL待测溶液。
②移取25.00 mL待测溶液于锥形瓶中,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(已知:I2 +2S2O![]() ===2I-+S4O
===2I-+S4O![]() )。
)。
(4)样品中NaClO2的质量分数为__________(用含m、c、V的代数式表示)。
【答案】(1)吸收多余的ClO2气体,防止污染环境
防止倒吸(或作安全瓶等其他正确说法)
(2)2NaClO3+Na2SO3+H2SO4(浓)===2ClO2↑+2Na2SO4+H2O
(3)用38~60 ℃的温水洗涤
(4) ![]() %(或
%(或![]() )
)
【解析】(1)装置中有未反应的ClO2,装置①可以吸收未反应的ClO2,防止逸出污染空气;装置④中气体发生反应,装置内压强降低,装置③防止倒吸。(2)亚硫酸钠具有还原性,在反应中作还原剂;装置②中产生ClO2的反应是氯酸钠在酸性溶液中氧化亚硫酸钠为硫酸钠,本身被还原为二氧化氯,反应的化学方程式为2NaClO3+Na2SO3+H2SO4(浓)===2ClO2↑+2Na2SO4+H2O。(3)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO2·3H2O,应趁热过滤,由题目信息可知,应控制温度38~60 ℃进行洗涤,低于60 ℃干燥。(4)令样品中NaClO2的质量分数为a,根据化学方程式得关系式:
NaClO2~2I2~4S2O![]()
90.5 g 4 mol
ma g c mol·L-1×V×10-3L×100 mL/25mL
则90.5 g∶m a g=4 mol∶(c mol·L-1×V×10-3L×100 mL/25 mL)
解得a=![]() %。
%。


科目:高中化学 来源: 题型:
【题目】用饱和的FeCl3溶液制取Fe(OH)3胶体,正确的操作是( )
A.将FeCl3溶液滴人蒸馏水中
B.将FeCl3溶液滴人热水中,生成棕黄色液体
C.将FeCl3溶液滴人沸水中,并继续煮沸至生成红褐色液体
D.将FeCl3溶液滴人沸水中,并继续煮沸至生成红褐色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.52 g镁铜合金完全溶解于50 mL密度为1.40 g·mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体 1 120 mL(标准状况),向反应后的溶液中加入1.0 mol·L-1NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。请完成下列问题:
(1)该合金中镁与铜的物质的量之比是 ;
(2)NO2和N2O4的混合气体中,NO2的体积分数是 ;
(3)得到2.54 g沉淀时,加入NaOH溶液的体积是 mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用H++OH﹣=H2O表示的化学方程式是( )
A.氢氧化钠溶液与醋酸反应
B.氢氧化铁与硫酸反应
C.氢氧化钡与硫酸反应
D.硫酸氢钠与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.使用容量瓶前检查它是否漏水
B.用容量瓶配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用滴管滴加蒸馏水到标线
C.容量瓶用蒸馏水洗净后不烘干就可使用
D.闻任何化学药品的气味都不能使鼻子凑近药品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以磷石膏(主要成分CaSO4,杂质SiO2、Al2O3等)为原料可制备轻质CaCO3,流程图如下。
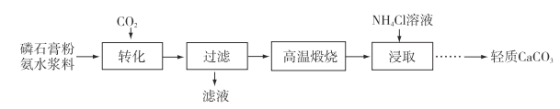
(1)匀速向浆料中通入CO2,浆料清液的pH和c(SO42-)随时间变化见如下图。清液pH>11时CaSO4转化的离子方程式为________;能提高其转化速率的措施有________(填序号)。

A.搅拌浆料
B.加热浆料至100 ℃
C.增大氨水浓度
D.减小CO2通入速率
(2)当清液pH接近6.5时,过滤并洗涤固体。滤液中物质的量浓度最大的两种阴离子为________和__________(填化学式);检验洗涤是否完全的方法是_____________________。
(3)在敞口容器中,用NH4Cl溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中c(Ca2+)增大的原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温下的六份溶液:①0.01mol/LCH3COOH溶液;②0.01mol/LHCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01mol/LCH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01mol/LHCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
⑴其中水的电离程度最大的是 (选填序号,下同),水的电离程度相同的是 ;
⑵若将②、③混合后所得溶液pH=7,则消耗溶液的体积:② ③(选填“>”、“<”或“=”);
⑶将六份溶液同等程度稀释10倍后,溶液的pH:① ②,③ ④(选填“>”、“<”或“=”);
⑷某二元酸H2A电离方程式是H2A=H++HA-、HA-![]() A2-+H+。回答下列问题:
A2-+H+。回答下列问题:
①Na2A溶液显__________性,理由是__________(用离子方程式表示).
②若0.1mol/LNaHA溶液的pH=2,则0.1mol/LH2A溶液中氢离子的物质的量浓度可能__________0.11mol/L(填“<”、“>”或“=”)理由是______________.
③0.1mol/LNaHA溶液中各离子浓度由大到小的顺序是______________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com