
【题目】下列说法不正确的是( )
A.使用容量瓶前检查它是否漏水
B.用容量瓶配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用滴管滴加蒸馏水到标线
C.容量瓶用蒸馏水洗净后不烘干就可使用
D.闻任何化学药品的气味都不能使鼻子凑近药品
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)是工业制硫酸的主要反应之一。恒温条件下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。
2SO3(g)是工业制硫酸的主要反应之一。恒温条件下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。
甲 | 乙 | 丙 | ||
起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 |
n(O2)/mol | 0.24 | 0.24 | 0.48 | |
SO2的平衡转化率/% | 80 | α1 | α2 | |
下列判断中,正确的是
A.甲中反应的平衡常数小于乙
B.该温度下,平衡常数值为400
C.平衡时,丙中c(SO3)是甲中的2倍
D.平衡时,甲中O2的转化率大于乙中O2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 含氟牙膏含氟越高越好
B. 牙膏中加入抗菌剂可起到预防龋齿的作用
C. 牙膏的主要成分包括摩擦剂和清洁剂
D. 由于铝元素对人体有害,所以牙膏中不能有氢氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到实验目的的是( )
A.检验NH![]() 时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体
时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体
B.向做完蔗糖水解后的溶液中直接加入新制的Cu(OH)2并加热,以检验蔗糖是否水解
C.将混有HCl的CO2通入饱和Na2CO3溶液中除去HCl
D.将Al2(SO4)3溶液蒸干制备Al2(SO4)3固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SiCl4是生产光纤预制棒的基础原料。通常在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500 ℃)。以下是实验室制备四氯化硅的装置示意图。

相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物 质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
沸点/℃ | 57.7 | 12.8 | - | 315 | - |
熔点/℃ | -70.0 | -107.2 | - | - | - |
升华温度/℃ | - | 180 | 300 | 162 |
请回答下列问题:
(1)实验室用二氧化锰和浓盐酸加热制取氯气,发生装置中除圆底烧瓶、酒精灯和导管外还需用到的玻璃仪器有________________
(2)装置C中的试剂是____________;整套实验装置存在一处明显的不足,请指出:______________。
(3)装置E中g瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是____________(填写元素符号)。
(4)F中吸收尾气一段时间后,吸收液中肯定存在OH- 、Cl-和SO![]() 。请设计实验,探究该吸收液中可能存在的其他酸根离子(忽略空气中CO2 的影响)。
。请设计实验,探究该吸收液中可能存在的其他酸根离子(忽略空气中CO2 的影响)。
【提出假设】假设1:只有SO![]() ;假设2:既无SO
;假设2:既无SO![]() ,也无ClO-;假设3:__________________。
,也无ClO-;假设3:__________________。
【实验探究】可供选择的实验试剂有:3 mol·L-1H2SO4、1 mol·L-1 NaOH、0.01 mol·L-1 KMnO4、溴水、淀粉-KI、品红等溶液。
取少量吸收液于试管中,滴加3 mol·L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于a、b、c三支试管中,分别进行下列实验。请完成下表:
序号 | 操 作 | 可能出现的现象 | 结 论 |
① | 向a试管中滴加几滴_________ | 若溶液褪色 | 则假设1成立 |
若溶液不褪色 | 则假设2或3成立 | ||
② | 向b试管中滴加几滴__________________ | 若溶液褪色 | 则假设1或3成立 |
若溶液不褪色 | 假设2成立 | ||
③ | 向c试管中滴加几滴_____________ | ________ | 假设3成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体。
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。Ba(ClO)2可溶于水。利用下图所示装置进行实验。
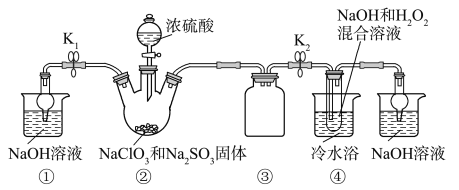
(1)装置①的作用是_______________,装置③的作用是______________________。
(2)装置②中产生ClO2气体的化学方程式为________________________。
(3)从装置④反应后的溶液获得晶体NaClO2的操作步骤为:
①减压,55 ℃蒸发结晶;
②趁热过滤;
③________________________;
④低于60 ℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。设计如下实验方案,并进行实验。
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO![]() +4I-+4H+===2H2O+2I2+Cl-)。将所得混合液配成100 mL待测溶液。
+4I-+4H+===2H2O+2I2+Cl-)。将所得混合液配成100 mL待测溶液。
②移取25.00 mL待测溶液于锥形瓶中,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(已知:I2 +2S2O![]() ===2I-+S4O
===2I-+S4O![]() )。
)。
(4)样品中NaClO2的质量分数为__________(用含m、c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物质资源是一种污染小的可再生能源,生物质的主要转化途径及主要产物如图。
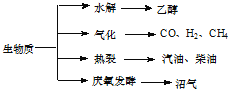
(1)下列有关说法正确的是
A.生物质能,本质上能量来源于太阳能
B.由纤维素水解获得的乙醇属生物质能
C.生物质裂解获得的汽油、柴油等属于纯净物
D.由植物秸秆等发酵获得的沼气,主要成分是甲烷
(2) 由生物质能获得的CO和H2,当两者1: 1催化反应,其原子利用率达100%,合成的物质可能是________。
A.汽油 B.甲醇 C.甲醛(HCHO) D.乙酸
(3) 已知在生物质气化炉中可发生:
C(s)+CO2(g)═2CO(g);△H=+172kJ/mol
CH4(g)+H2O(g)═CO(g)+3H2(g);△H=+206kJ/mol
CH4(g)+2H2O(g)═CO2(g)+4H2(g);△H=+165kJ/mol
则C(s)+H2O(g)═CO(g)+H2(g);△H=____________kJ/mol.
(4)由生物质能获得的CO和H2可以用来合成液态燃料甲醇,实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:_________________。
(5) 己知稀溶液中,1molH2SO4与NaOH溶液恰好完全反应时,放出114.6kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na 、Fe 、Cl 是中学化学常见的元素。回答下列问题:
(1)含上述元素的常见化合物中,呈淡黄色的是 (填化学式)。
(2)焰色反应的实验中,Na元素燃烧时的焰色为 色,观察 K元素燃烧时的焰色需要透过 。
(3)实验室在制备 Fe(OH)2 时必须隔绝空气,否则发生的现象是 。
(4)Mg与碳粉和氯气在一定条件下反应可制备 MgCl2,该反应的化学方程式为 。若尾气可用足量 NaOH溶液完全吸收,则生成的盐为 (写化学式)。
(5)由 NO、H2、CO2组成的混合气体,先通过足量的 Na2O2充分反应后,再将混合气体用电火花引燃,充分反应后最终只得到质量分数为 70%的硝酸,无其他气体剩余。则原混合气体中 NO、H2、CO2的体积比为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com