
【题目】生物质资源是一种污染小的可再生能源,生物质的主要转化途径及主要产物如图。
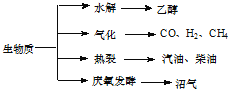
(1)下列有关说法正确的是
A.生物质能,本质上能量来源于太阳能
B.由纤维素水解获得的乙醇属生物质能
C.生物质裂解获得的汽油、柴油等属于纯净物
D.由植物秸秆等发酵获得的沼气,主要成分是甲烷
(2) 由生物质能获得的CO和H2,当两者1: 1催化反应,其原子利用率达100%,合成的物质可能是________。
A.汽油 B.甲醇 C.甲醛(HCHO) D.乙酸
(3) 已知在生物质气化炉中可发生:
C(s)+CO2(g)═2CO(g);△H=+172kJ/mol
CH4(g)+H2O(g)═CO(g)+3H2(g);△H=+206kJ/mol
CH4(g)+2H2O(g)═CO2(g)+4H2(g);△H=+165kJ/mol
则C(s)+H2O(g)═CO(g)+H2(g);△H=____________kJ/mol.
(4)由生物质能获得的CO和H2可以用来合成液态燃料甲醇,实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:_________________。
(5) 己知稀溶液中,1molH2SO4与NaOH溶液恰好完全反应时,放出114.6kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式_________________。
【答案】(1)abd(3分)(2)cd(2分)(3)+131(kJ/mol)(2分)
(4)CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=-726.4kJ/mol(3分)
O2(g)=CO2(g)+2H2O(l) △H=-726.4kJ/mol(3分)
(5)![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l) △H=-57.3kJ/mol(3分)
Na2SO4(aq)+H2O(l) △H=-57.3kJ/mol(3分)
【解析】
试题分析:(1)a.生物质本质上能来源于太阳能,故A正确; b.乙醇来源于纤维素,属于生物质能,故B正确;c.汽油、柴油等属于混合物,故C错误;d.沼气的主要成分是甲烷,故D正确;故选abd;
(2))“绿色化学”能实现零排放,即反应物中的原子利用率达到100%,也就是说反应类型一般是化合反应,且反应后产物中的各原子数目比不变,CO和H2在一定条件下按照不同的比例反应,可假定反应时的化学计量数之比为1:1,则只要各选项中的化学式能化为形式(CO)n(H2)n,都是正确的,汽油是混合物,甲醇(CH4O)可变为(CO)1(H2)2,甲醛(CH2O)可变为(CO)1(H2)1,乙酸(C2H4O2)可变为(CO)2(H2)2,故答案为cd;
(3)已知:①C(s)+CO2(g)=2CO(g)△H=172kJ/mol
②CH4(g)+H2O(g)=CO(g)+3H2(g)△H=206kJ/mol
③CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=165kJ/mol
为求C(s)+H2O(g)=CO(g)+H2(g);△H1的反应热,可用盖斯定律将①+③-②可得:
△H=172kJ/mol+165kJ/mol-206kJ/mol=+131kJ/mol;
(4)5gCH3OH在氧气中燃烧生成CO2和液态水,放出113.5kJ热量,64g即1molCH3OH在氧气中燃烧生成CO2和液态水,放出1452.8kJ热量,则热化学方程式为:2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452.8KJ;
(5)1molH2SO4溶液与足量 NaOH溶液完全反应,放出114.6kJ的热量,即生成2mol水放出114.6kJ的热量,反应的反应热为-114.6kJ/mol,中和热为-57.3kJ/mol,则中和热的热化学方程式![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l) △H=-57.3kJ/mol。
Na2SO4(aq)+H2O(l) △H=-57.3kJ/mol。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】能用H++OH-=H2O来表示的化学反应是
A. 氢氧化镁和稀盐酸反应 B. Ba(OH)2溶液滴入稀硫酸中
C. 澄清石灰水和稀硝酸反应 D. 二氧化碳通入澄清石灰水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.使用容量瓶前检查它是否漏水
B.用容量瓶配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用滴管滴加蒸馏水到标线
C.容量瓶用蒸馏水洗净后不烘干就可使用
D.闻任何化学药品的气味都不能使鼻子凑近药品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在298K和101KPa时,2N2O5(g)=4NO2(g)+O2(g);△H=+56.7kJ/mol,能自发进行的合理解释是
A. 是熵减反应 B. 是熵增效应大于能量效应
C. 是吸热反应 D. 是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以磷石膏(主要成分CaSO4,杂质SiO2、Al2O3等)为原料可制备轻质CaCO3,流程图如下。
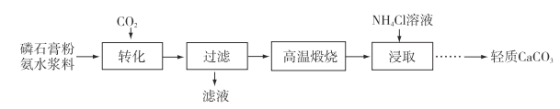
(1)匀速向浆料中通入CO2,浆料清液的pH和c(SO42-)随时间变化见如下图。清液pH>11时CaSO4转化的离子方程式为________;能提高其转化速率的措施有________(填序号)。

A.搅拌浆料
B.加热浆料至100 ℃
C.增大氨水浓度
D.减小CO2通入速率
(2)当清液pH接近6.5时,过滤并洗涤固体。滤液中物质的量浓度最大的两种阴离子为________和__________(填化学式);检验洗涤是否完全的方法是_____________________。
(3)在敞口容器中,用NH4Cl溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中c(Ca2+)增大的原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶体区别于其他分散系的本质特征是
A.胶体的分散质能通过滤纸孔隙,而浊液的分散质不能
B.胶体能产生丁达尔现象
C.胶体分散质粒子直径在1~100 nm之间
D.胶体在一定条件下能稳定存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在澄清透明的强碱性溶液中,下列离子组能大量共存是
A.Na+、H+、Cl- B.Na+、HCO3-、NO3-
C.K+、NH4+、CO32- D.Ba2+、Cl-、NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com