
【题目】SiCl4是生产光纤预制棒的基础原料。通常在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500 ℃)。以下是实验室制备四氯化硅的装置示意图。

相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物 质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
沸点/℃ | 57.7 | 12.8 | - | 315 | - |
熔点/℃ | -70.0 | -107.2 | - | - | - |
升华温度/℃ | - | 180 | 300 | 162 |
请回答下列问题:
(1)实验室用二氧化锰和浓盐酸加热制取氯气,发生装置中除圆底烧瓶、酒精灯和导管外还需用到的玻璃仪器有________________
(2)装置C中的试剂是____________;整套实验装置存在一处明显的不足,请指出:______________。
(3)装置E中g瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是____________(填写元素符号)。
(4)F中吸收尾气一段时间后,吸收液中肯定存在OH- 、Cl-和SO![]() 。请设计实验,探究该吸收液中可能存在的其他酸根离子(忽略空气中CO2 的影响)。
。请设计实验,探究该吸收液中可能存在的其他酸根离子(忽略空气中CO2 的影响)。
【提出假设】假设1:只有SO![]() ;假设2:既无SO
;假设2:既无SO![]() ,也无ClO-;假设3:__________________。
,也无ClO-;假设3:__________________。
【实验探究】可供选择的实验试剂有:3 mol·L-1H2SO4、1 mol·L-1 NaOH、0.01 mol·L-1 KMnO4、溴水、淀粉-KI、品红等溶液。
取少量吸收液于试管中,滴加3 mol·L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于a、b、c三支试管中,分别进行下列实验。请完成下表:
序号 | 操 作 | 可能出现的现象 | 结 论 |
① | 向a试管中滴加几滴_________ | 若溶液褪色 | 则假设1成立 |
若溶液不褪色 | 则假设2或3成立 | ||
② | 向b试管中滴加几滴__________________ | 若溶液褪色 | 则假设1或3成立 |
若溶液不褪色 | 假设2成立 | ||
③ | 向c试管中滴加几滴_____________ | ________ | 假设3成立 |
【答案】(1)分液漏斗 (2)浓硫酸 装置E和F之间未连接干燥管 (3)Al、P (4)只有ClO- ①溴水(或0.01 mol·L-1KMnO4溶液) ②品红溶液 ③淀粉-KI溶液 若溶液变为蓝色
【解析】(1)根据题意,实验室制备氯气还需要的玻璃仪器是分液漏斗。(2)装置C为干燥Cl2的装置,所用试剂是浓H2SO4,观察实验装置可以发现装置E和F之间未连接干燥管,水蒸气进入E中,会引起生成的SiCl4水解。(3)精馏时沸点低的BCl3先蒸出,故残留物中还含有沸点高的杂质元素Al、P。(4)F中吸收的尾气主要是Cl2,当Cl2不足时为假设1:只有SO;当Cl2恰好反应时为假设2:既无SO32-也无ClO-;当Cl2过量时为假设3:只有ClO-。要探究SO32-是否存在,用氧化剂,因其具有还原性,结合可能出现的现象和结论作答。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体________g。
(2)从下图中选择称量NaOH固体所需要的仪器(填字母):__________ 。
名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 |
|
|
|
|
|
|
序号 | a | b | c | d | e | f |
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示。
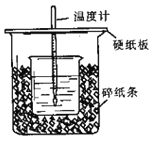
(1)此装置哪些地方需要改进:________________
(2)写出该反应的中和热的热化学方程式(中和热为57.3 kJ·mol-1):__________________
(3
起始温度/℃ | 终止温度/℃ | 温度差/℃ | |||
H2SO4 | NaOH | 平均值 | |||
1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
2 | 24.5 | 24.2 | 24.35 | 27.6 | 3.25 |
3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
①近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。则中和热ΔH=_______________(取小数点后一位)。
②上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母)____________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(4)如果用50 mL 0.55 mol·L-1的氨水代替NaOH溶液进行上述实验,其放出的热量偏小,原因是________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.铜能导电,所以铜是电解质
B.BaSO4难溶于水,但BaSO4属于电解质
C.液态HCl不能导电,所以HCl是非电解质
D.氯气的水溶液能导电,氯气是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下食品中的有机成分属于高分子化合物的是
A. 谷类中含有的淀粉 B. 植物油、动物脂肪中含有的油脂
C. 食醋中含有的醋酸 D. 酒中含有的酒精
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X(s)+3Y(g)![]() Z(g) ΔH=-a kJ·molˉ1 ,一定条件下,将2mol X和2 mol Y通入2L的恒容密闭容器中,反应10s,测得生成0.5molZ。下列说法正确的是
Z(g) ΔH=-a kJ·molˉ1 ,一定条件下,将2mol X和2 mol Y通入2L的恒容密闭容器中,反应10s,测得生成0.5molZ。下列说法正确的是
A.10s内,X的平均反应速率为0.025 mol·Lˉ1·sˉ1
B.第10s时,Y的反应速率为0.075 mol·Lˉ1·sˉ1
C.第10s时,X为 1.5 mol,Y的浓度为0.25 mol·Lˉ1
D.10s内,X和Y反应放出的热量为a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.使用容量瓶前检查它是否漏水
B.用容量瓶配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用滴管滴加蒸馏水到标线
C.容量瓶用蒸馏水洗净后不烘干就可使用
D.闻任何化学药品的气味都不能使鼻子凑近药品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在298K、1.01×10 5Pa下,将22gCO2通入750mLl mol./LNaOH溶液中充分反应,测得反应放出xkJ的热量。己知在该条件下,1molCO2通入lL2mol ·L-1NaOH溶液中充分反应放出y kJ的热量,则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是
A. CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-(2y-x)kJ·mol-l
B. CO2(g)+NaOH(aq)=NaHCO3(aq) △H =-(2x-y) kJ·mol-l
C. CO2(g)+NaOH(aq)=NaHCO3(aq) △H =-(4x-y) kJ·mol-l
D. CO2(g)+NaOH(l)=NaHCO3(l) △H =-(4x-y) kJ·mol-l
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在298K和101KPa时,2N2O5(g)=4NO2(g)+O2(g);△H=+56.7kJ/mol,能自发进行的合理解释是
A. 是熵减反应 B. 是熵增效应大于能量效应
C. 是吸热反应 D. 是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A. 在化学反应过程中,发生物质变化的同时不一定发生能量变化
B. 破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量时,反应为吸热反应
C. 生成物的总能量大于反应物的总能量时,反应吸热,ΔH>0
D. ΔH的大小与热化学方程式的化学计量数无关
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com