
【题目】下列说法中,正确的是
A. 在化学反应过程中,发生物质变化的同时不一定发生能量变化
B. 破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量时,反应为吸热反应
C. 生成物的总能量大于反应物的总能量时,反应吸热,ΔH>0
D. ΔH的大小与热化学方程式的化学计量数无关
科目:高中化学 来源: 题型:
【题目】SiCl4是生产光纤预制棒的基础原料。通常在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500 ℃)。以下是实验室制备四氯化硅的装置示意图。

相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物 质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
沸点/℃ | 57.7 | 12.8 | - | 315 | - |
熔点/℃ | -70.0 | -107.2 | - | - | - |
升华温度/℃ | - | 180 | 300 | 162 |
请回答下列问题:
(1)实验室用二氧化锰和浓盐酸加热制取氯气,发生装置中除圆底烧瓶、酒精灯和导管外还需用到的玻璃仪器有________________
(2)装置C中的试剂是____________;整套实验装置存在一处明显的不足,请指出:______________。
(3)装置E中g瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是____________(填写元素符号)。
(4)F中吸收尾气一段时间后,吸收液中肯定存在OH- 、Cl-和SO![]() 。请设计实验,探究该吸收液中可能存在的其他酸根离子(忽略空气中CO2 的影响)。
。请设计实验,探究该吸收液中可能存在的其他酸根离子(忽略空气中CO2 的影响)。
【提出假设】假设1:只有SO![]() ;假设2:既无SO
;假设2:既无SO![]() ,也无ClO-;假设3:__________________。
,也无ClO-;假设3:__________________。
【实验探究】可供选择的实验试剂有:3 mol·L-1H2SO4、1 mol·L-1 NaOH、0.01 mol·L-1 KMnO4、溴水、淀粉-KI、品红等溶液。
取少量吸收液于试管中,滴加3 mol·L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于a、b、c三支试管中,分别进行下列实验。请完成下表:
序号 | 操 作 | 可能出现的现象 | 结 论 |
① | 向a试管中滴加几滴_________ | 若溶液褪色 | 则假设1成立 |
若溶液不褪色 | 则假设2或3成立 | ||
② | 向b试管中滴加几滴__________________ | 若溶液褪色 | 则假设1或3成立 |
若溶液不褪色 | 假设2成立 | ||
③ | 向c试管中滴加几滴_____________ | ________ | 假设3成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,将3 mol A和1 mol B气体通入体积为2 L的密闭容器中(容积固定不变),发生如下反应:3A(g)+B(g)![]() xC(g),ΔH<0;在2 min时反应达到平衡状态(温度不变) 剩余了0.8 mol B,并测得C的浓度为0.4 mol/L,请填写下列空白:
xC(g),ΔH<0;在2 min时反应达到平衡状态(温度不变) 剩余了0.8 mol B,并测得C的浓度为0.4 mol/L,请填写下列空白:
(1)从开始反应至达到平衡状态,生成C的平均反应速率为________________;
(2)x=_______;
(3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡(填字母)________。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+Cl2(g)="2HCl(g)" ΔH=-184.6 kJ·mol-1,则反应HCl(g)=1/2H2(g)+1/2Cl2(g)的ΔH为
A. +184.6 kJ·mol-1 B. -92.3 kJ·mol-1
C. +92.3 kJ D. +92.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的发法:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1.某科学实验将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图1所示(实线).图中数据a(1,6)代表的意思是:在1min时H2的物质的量是6mol。
CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1.某科学实验将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图1所示(实线).图中数据a(1,6)代表的意思是:在1min时H2的物质的量是6mol。
①a点正反应速率____________(填大于、等于或小于)逆反应速率。
②下列时间段平均反应速率最大的是__________,最小的是__________.
A.0~1min B.1~3min C.3~8min D.8~11min
③仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是__________,曲线Ⅱ对应的实验条件改变是__________。
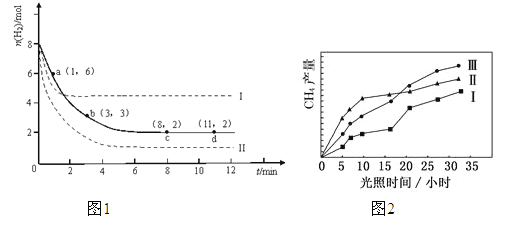
(2)利用光能和光催化剂,可将 CO2和 H2O(g)转化为 CH4和 O2。紫外光照射时,在不同催化剂(Ⅰ,Ⅱ,Ⅲ)作用下,CH4产量随光照时间的变化如图所示。在0~30小时内,CH4的平均生成速率 vⅠ、vⅡ和vⅢ从大到小的顺序为____________;反应开始后的12小时内,在第__________种催化剂作用下,收集的 CH4最多。
(3) 1100 ℃时,体积为2L的恒容容器中发生如下反应:
Na2SO4(s)+4H2(g)![]() Na2S(s)+4H2O(g),下列能判断反应达到平衡状态的是__________。
Na2S(s)+4H2O(g),下列能判断反应达到平衡状态的是__________。
A.容器内气体压强不再变化
B.H2的体积分数不再变化
C.lmolH--H键断裂同时2molH--O键形成
D.Na2S的质量不再变化
E.v正(H2)=v逆(H2O)
F.容器内气体密度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na 、Fe 、Cl 是中学化学常见的元素。回答下列问题:
(1)含上述元素的常见化合物中,呈淡黄色的是 (填化学式)。
(2)焰色反应的实验中,Na元素燃烧时的焰色为 色,观察 K元素燃烧时的焰色需要透过 。
(3)实验室在制备 Fe(OH)2 时必须隔绝空气,否则发生的现象是 。
(4)Mg与碳粉和氯气在一定条件下反应可制备 MgCl2,该反应的化学方程式为 。若尾气可用足量 NaOH溶液完全吸收,则生成的盐为 (写化学式)。
(5)由 NO、H2、CO2组成的混合气体,先通过足量的 Na2O2充分反应后,再将混合气体用电火花引燃,充分反应后最终只得到质量分数为 70%的硝酸,无其他气体剩余。则原混合气体中 NO、H2、CO2的体积比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的变化,不能通过一步化学反应完成的是
A. Cu→CuSO4 B. SiO2→H2SiO3 C. Cl2→HClO D. NO2→HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃的纯水中通入一定量的氯化氢,当溶液的pH=1时,则由水电离出的c(H+)是
A.1×10-1mol/L B.1×10-6mol/L C.1×10-3mol/L D.1×10-13mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《化学与生活》
(1)国庆是传统的节日。在外地的人们会乘坐各种交通工具回家与亲人团圆。
① 航空旅行舒适快捷。制造飞机轮胎的主要材料是 (填字母)。
a.铝合金 b.橡胶 c.玻璃
② 铁路是主要的交通工具。建设铁路需要大量水泥。工业上生产水泥的主要原料是石灰石和 (填字母)。
a.黏土 b.纯碱 c.石英
③ 轮船也是重要的交通工具。为保护钢板不受腐蚀,在船尾钢板上镶嵌的金属块是 (填字母)。
a.铜块 b.锌块 c.锡块
(2)国庆节期间聚会要注意饮食健康,保证身体健康。
①平时要多喝水。水在人体中有重要的生理功能。下列物质在人体中可以水解的是 (填字母)
a.葡萄糖 b.氨基酸 c.油脂
②合理选择饮食。鸡、鸭、鱼、肉是常见食材,它们富含的营养物质是油脂和 ;富含淀粉的面点老少皆宜,淀粉的化学式是 ;蔬菜和水果富含维生素C,是人体所必须的。医用维生素C片常在药片外包裹一层“糖衣”,其作用除了改善口感外,更重要的作用是 。
③橙汁是家宴的常用饮品。某品牌橙汁中含有白砂糖、精制盐、柠檬黄和苯甲酸钠,这几种物质中属于着色剂的是 。
④饮食不当会引起胃痛。胃舒平[主要成分是Al(OH)3]可治疗胃酸过多,写出Al(OH)3与胃酸反应的离子方程式 。
(3)国庆期间,在娱乐、购物、旅游时要讲究文明、保护环境。
①蓝天白云是假日出行的最佳天气,“阅兵蓝”为2015年科技热词。较多排放下列气体不利于蓝天出现的是 (填字母)。
a.N2 b. NO2 c.CO2
②用过的聚乙烯塑料食品袋要投入贴有可回收物标志的垃圾箱中。聚乙烯的结构简式是 。
③私家车给假日旅游带来方便,但添堵、污染不可回避。汽车尾气中的CO和NO2在催化剂的作用下可转化为无害气体排出,其化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com