
【题目】某同学购买了一瓶“84消毒液”,包装说明如下:
净含量:1 000 mL 密度:1.19 g·cm-3
主要成分:25%NaClO
使用方法:稀释100倍(体积比)后使用
注意事项:密封保存,易吸收空气中的CO2变质
请根据以上信息和相关知识判断,下列分析不正确的是( )
A.该“84消毒液”的物质的量浓度约为4.0 mol·L-1
B.一瓶该“84消毒液”能吸收空气中44.8 L的CO2(标准状况)而变质
C.取100 mL该“84消毒液”稀释100倍后用以消毒,稀释后的溶液中c(Na+)约为0.04 mol·L-1
D.参阅该“84消毒液”的配方,欲用NaClO固体配制含25%NaClO的消毒液480 mL,需要称量的NaClO固体质量为143 g
【答案】D
【解析】选D。选项A,根据c=![]() 得,c(NaClO)=
得,c(NaClO)=![]() ≈4.0 mol·L-1;选项B;一瓶该“84消毒液”含有n(NaClO)=1 L×4.0 mol·L-1=4.0 mol,根据反应:CO2+2NaClO+H2O===Na2CO3+2HClO,可知吸收CO2的物质的量n(CO2)=
≈4.0 mol·L-1;选项B;一瓶该“84消毒液”含有n(NaClO)=1 L×4.0 mol·L-1=4.0 mol,根据反应:CO2+2NaClO+H2O===Na2CO3+2HClO,可知吸收CO2的物质的量n(CO2)=![]() n(NaClO)=2.0 mol,即标准状况下V(CO2)=2.0 mol×22.4 L·mol-1=44.8 L;选项C,根据稀释前后溶质的物质的量不变有:100 mL×4.0 mol·L-1=100 mL×100×c(NaClO),解得稀释后c(NaClO)=0.04 mol·L-1,c(Na+)=c(NaClO)=0.04 mol·L-1;选项D,应选取500 mL规格的容量瓶进行配制,然后取出480 mL,所以需要NaClO的质量为0.5 L×4.0 mol·L-1×74.5 g·mol-1=149 g。
n(NaClO)=2.0 mol,即标准状况下V(CO2)=2.0 mol×22.4 L·mol-1=44.8 L;选项C,根据稀释前后溶质的物质的量不变有:100 mL×4.0 mol·L-1=100 mL×100×c(NaClO),解得稀释后c(NaClO)=0.04 mol·L-1,c(Na+)=c(NaClO)=0.04 mol·L-1;选项D,应选取500 mL规格的容量瓶进行配制,然后取出480 mL,所以需要NaClO的质量为0.5 L×4.0 mol·L-1×74.5 g·mol-1=149 g。


科目:高中化学 来源: 题型:
【题目】以磷石膏(主要成分CaSO4,杂质SiO2、Al2O3等)为原料可制备轻质CaCO3,流程图如下。
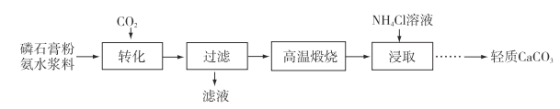
(1)匀速向浆料中通入CO2,浆料清液的pH和c(SO42-)随时间变化见如下图。清液pH>11时CaSO4转化的离子方程式为________;能提高其转化速率的措施有________(填序号)。

A.搅拌浆料
B.加热浆料至100 ℃
C.增大氨水浓度
D.减小CO2通入速率
(2)当清液pH接近6.5时,过滤并洗涤固体。滤液中物质的量浓度最大的两种阴离子为________和__________(填化学式);检验洗涤是否完全的方法是_____________________。
(3)在敞口容器中,用NH4Cl溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中c(Ca2+)增大的原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温下的六份溶液:①0.01mol/LCH3COOH溶液;②0.01mol/LHCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01mol/LCH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01mol/LHCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
⑴其中水的电离程度最大的是 (选填序号,下同),水的电离程度相同的是 ;
⑵若将②、③混合后所得溶液pH=7,则消耗溶液的体积:② ③(选填“>”、“<”或“=”);
⑶将六份溶液同等程度稀释10倍后,溶液的pH:① ②,③ ④(选填“>”、“<”或“=”);
⑷某二元酸H2A电离方程式是H2A=H++HA-、HA-![]() A2-+H+。回答下列问题:
A2-+H+。回答下列问题:
①Na2A溶液显__________性,理由是__________(用离子方程式表示).
②若0.1mol/LNaHA溶液的pH=2,则0.1mol/LH2A溶液中氢离子的物质的量浓度可能__________0.11mol/L(填“<”、“>”或“=”)理由是______________.
③0.1mol/LNaHA溶液中各离子浓度由大到小的顺序是______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.1mol任何气体的体积都约是22.4L
B.lmolH2和O2的混合气体,在标准状况下的体积约为22.4L
C.lmol H2气态物质,当体积为22.4L时,该气体一定处于标准状况
D.标准状况下,2molH2O体积约为44.8L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在澄清透明的强碱性溶液中,下列离子组能大量共存是
A.Na+、H+、Cl- B.Na+、HCO3-、NO3-
C.K+、NH4+、CO32- D.Ba2+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 甲烷与乙烯互为同系物
B. 32S与33S是同种核素
C. 正丁烷与异丁烷互为同素异形体
D. 乙醇和二甲醚(CH3-O-CH3)互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱在日常生活和化学工业中用途很广,如用于硬水软化、洗涤剂生产、食品加工、石油精炼、粗盐精制、玻璃制造等领域。工业上以食盐、氨气(主要由合成氨厂提供)和二氧化碳为主要原料生产纯碱。其流程如下:
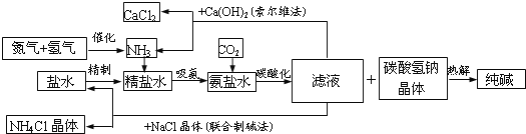
(1)盐水精制的过程是除去溶液中各种杂质的过程.为将盐水中含有的Ca2+、Mg2+等沉淀,可以向其中加入过量纯碱.此时将混合液中不溶物除去的方法是 ,该操作中所用的仪器有铁架台 (带铁圈)、 玻璃棒、烧杯等, 还需要使用的仪器有 ,溶液中多余的纯碱可以加 试剂来除去。
(2)上述工艺流程中,加压条件下通入二氧化碳进行碳酸化时没有析出碳酸钠晶体,其原因是 。整个过程中循环利用的物质是 (用化学式表示)。
(3)若采用上述流程生产106吨纯碱,则理论上通入的二氧化碳的体积(标准状况下)不得少于 L(不考虑二氧化碳的回收利用)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2015·新课标全国Ⅰ]我国清代《本草纲目拾遗》中记叙无机药物335种,其中“强水”条目下写道:“性最烈,能蚀五金……其水甚强,五金八石皆能穿滴,惟玻璃可盛。”这里的“强水”是指
A.氨水 B.硝酸 C.醋 D.卤水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com