
���ô�������Ӧ��SO2ת��ΪSO3�ǹ�ҵ����������Ĺؼ����衣
��֪��SO2��g���� O2��g��
O2��g�� SO3��g�� ��H����98 kJ��mol��1��
SO3��g�� ��H����98 kJ��mol��1��
��1��ij�¶��¸÷�Ӧ��ƽ�ⳣ��K��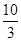 �����ڴ��¶��£���100 L�ĺ����ܱ������У�����3.0 mol SO2(g)��16.0 mol O2(g)��3.0 mol SO3(g)����Ӧ��ʼʱv������ v���棩�����������������������
�����ڴ��¶��£���100 L�ĺ����ܱ������У�����3.0 mol SO2(g)��16.0 mol O2(g)��3.0 mol SO3(g)����Ӧ��ʼʱv������ v���棩�����������������������
��2��һ���¶��£���һ�����������Ϊ2 L���ܱ������г���2.0 mol SO2��1.0 molO2���ﵽƽ��������Ϊ1.6 L����SO2��ƽ��ת����Ϊ ��
��3���ڣ�2���еķ�Ӧ�ﵽƽ��ı�������������ʹSO2(g)ƽ��Ũ�ȱ�ԭ����С���� ������ĸ����
| A�������¶Ⱥ�����������䣬����1.0 mol O2 |
| B�������¶Ⱥ�������ѹǿ���䣬����1.0 mol SO3 |
| C�������¶� |
| D���ƶ�����ѹ������ |
��1���� ��2��60% ��3��A��C��4��O2��4e����4 H+ ��2H2O��5��16:29
�������������(1)��100 L�ĺ����ܱ������У�����3.0 mol SO2(g)��16.0 mol O2(g)��3.0 mol SO3(g)���ɵ�K`=9/144��K`��K���ʷ�Ӧ������Ӧ�����ƶ�������Ӧ���ʣ��淴Ӧ���ʡ���2������SO2��g���� O2��g��
O2��g�� SO3��g�������Ϊ2 L���ܱ������г���2.0 mol SO2��1.0 molO2���ﵽƽ��������Ϊ1.6 L����֪��Ӧ��ѹǿ��Ϊԭ����1.6L/2L=80%���ʷ�Ӧ��������ʵ���Ϊ��2+1����80%=2.4mol��
SO3��g�������Ϊ2 L���ܱ������г���2.0 mol SO2��1.0 molO2���ﵽƽ��������Ϊ1.6 L����֪��Ӧ��ѹǿ��Ϊԭ����1.6L/2L=80%���ʷ�Ӧ��������ʵ���Ϊ��2+1����80%=2.4mol��
SO2��g���� O2��g��
O2��g�� SO3��g��
SO3��g��
��ʼ 2mol 1mol 0mol
��Ӧ 2a a 2a
���� 2-2a 1-a 2a ��(2-2a)+(1-a)+2a="2.4mol" ��a=0.6mol����SO2��ת����Ϊ��2-2��0.6��mol/2mol��100%=60%
��3��Aѡ����뷴Ӧ����������Ӧ������Ӧ������У�SO2Ũ�Ƚ��͡�Bѡ�����SO2����Ӧ������Ӧ������У���SO2ת���ʽ��ͣ�Ũ�����ߡ�Cѡ��÷�ӦΪ���ȷ�Ӧ�������¶ȣ�������Ӧ������У�SO2Ũ�Ƚ��͡�Dѡ�����ѹ�������ƽ��������Ӧ�����ƶ����������С��Ũ������ѡ��A��Cѡ���4��O2��4e����4 H+ ��2H2O��5���÷�Ӧ���ܷ�Ӧ����ʽӦΪ2SO2+O2+2H2O=2H2SO4�������SO2�����ʵ���Ϊa������H2O�����ʵ���Ϊb�� =0.5����a��b=9��58������ߵ�����֮��Ϊ16:29��
=0.5����a��b=9��58������ߵ�����֮��Ϊ16:29��
���㣺��ѧƽ�ⳣ���ĺ��壻�缫��Ӧ�͵�ط�Ӧ����ʽ����ѧƽ���Ӱ������ ��


 �ο�������ϵ�д�
�ο�������ϵ�д� ������ѧ��ʱ��ҵϵ�д�
������ѧ��ʱ��ҵϵ�д� ���������ʱ��ѵϵ�д�
���������ʱ��ѵϵ�д� �㽭�¿γ���άĿ�������ʱ��ѵϵ�д�
�㽭�¿γ���άĿ�������ʱ��ѵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�״�����Ҫ�Ļ�ѧ��ҵ����ԭ�Ϻ����Һ��ȼ�ϡ���ҵ�Ͽ�����CO��CO2������ȼ�ϼ״�����֪�״��Ʊ����йػ�ѧ��Ӧ�Լ��ڲ�ͬ�¶��µĻ�ѧ��Ӧƽ�ⳣ�����±���ʾ��
��1����Ӧ���� ������ȡ����ȡ�����Ӧ��
��2��ij�¶��·�Ӧ����H2��ƽ��ת���ʣ�a������ϵ��ѹǿ(P)�Ĺ�ϵ����ͼ��ʾ����ƽ��״̬��A�䵽Bʱ��ƽ�ⳣ��K(A) K(B)������������������������ݷ�Ӧ����ڿ��Ƶ���K1��K2��K3֮��Ĺ�ϵ����K3= ����K1��K2��ʾ����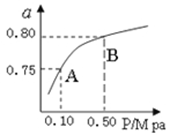
��3����3 L�ݻ��ɱ���ܱ������з�����Ӧ�ڣ���֪c(CO)�뷴Ӧʱ��t�仯���ߢ���ͼ��ʾ������t0ʱ�̷ֱ�ı�һ�����������ߢ��Ϊ���ߢ�����ߢ�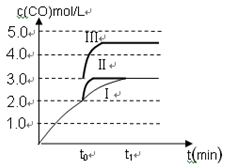
�����ߢ��Ϊ���ߢ�ʱ���ı�������� ��
�����ߢ��Ϊ���ߢ�ʱ���ı�������� ��
��4���״�ȼ�ϵ�����Ź㷺����;��ͬʱAl-AgO�����Ӧ�ù㷺������ �أ���ԭ����ͼ��ʾ���õ�صĸ�����Ӧʽ�� ��
��5��һ�������¼״���һ����̼��Ӧ���Ժϳ����ᡣͨ��״���£���a mol/L�Ĵ�����b mol/LBa(OH)2��Һ�������ϣ���Ӧƽ��ʱ��2c(Ba2��)= c(CH3COO��)���ú�a��b�Ĵ���ʽ��ʾ�û����Һ�д���ĵ��볣��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�����̵��ͺϳɵ����ܵ�����Ҫ��ʽ���±��Ǵ����̵��ͺϳɰ��IJ���Kֵ��
| | N2+O2 2NO 2NO | N2+3H2 2NH3 2NH3 | ||
| �¶� | 25�� | 2000�� | 25�� | 400�� |
| ƽ�ⳣ��K | 3.84��10-31 | 0.1 | 5��108 | 200 |
 Cu(NH3)2AC��CO(aq)+Q(Q>0)
Cu(NH3)2AC��CO(aq)+Q(Q>0) NH4++NH2-��
NH4++NH2-���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��450�沢�д��������£������Ϊ1L���ܱպ��������У���������������������·�Ӧ��2SO2+O2 2SO3
2SO3
��1����֪��64g SO2��ȫת��ΪSO3��ų�85kJ������SO2ת��ΪSO3���Ȼ�ѧ����ʽ�� ��
��2���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽK= ��
��3�������¶ȣ���ѧ��Ӧ�ٶ� ���÷�ӦKֵ�� ��ѹǿ�� ���������С�����䡱��
��4��450��ʱ����һ�ܱ������У�������������������ϣ���Ӧ������SO2��O2��SO3���ʵ����仯��ͼ����Ӧ����ƽ��״̬��ʱ����� ��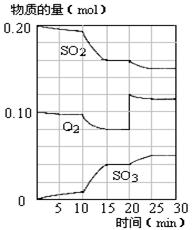
a��10-15min b��15-20min c��20-25min d��25-30min
��5����ͼ�жϣ�10min��15min�����߱仯��ԭ������� ����д��ţ���
a������SO3�����ʵ��� b����С������� c�������¶� d.����
��6����15����ʱ��SO2��ת������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��һ��������ܱ������У����л�ѧ��ӦCO2 (g)+H2 (g) CO (g)+H2O (g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
CO (g)+H2O (g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
| t / �� | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ij�¶��£���2mol A��2.8 mol B�������Ϊ2 L�ĺ����ܱ������У��������·�Ӧ��
aA��g��+B��g�� 2C��g��+ D��s�� ��5 min��ﵽƽ�⡣ƽ��ʱAΪ1.6mol���ų�������ΪQ����t0ʱ�̣�����ƽ����ϵ�з�����ķ�֮һ�Ļ�����壬��ƽ����ϵ��c(A)Ϊ0.6mol��L��
2C��g��+ D��s�� ��5 min��ﵽƽ�⡣ƽ��ʱAΪ1.6mol���ų�������ΪQ����t0ʱ�̣�����ƽ����ϵ�з�����ķ�֮һ�Ļ�����壬��ƽ����ϵ��c(A)Ϊ0.6mol��L��
��1�� 5 min����B��ʾ�÷�Ӧ�Ļ�ѧ��Ӧ����Ϊ ��
��2�����¶��£��˿��淴Ӧ���淴Ӧ��ƽ�ⳣ��Ϊ ��
��3��a��ֵΪ ��
��4������˵��һ����˵��������Ӧ�Ѵﵽƽ��״̬���� ��
�ٵ�λʱ����ÿ����1molB��ͬʱ������2mol��C ��D�����ʵ������ٱ仯
�ۻ��������ܶȲ��ٱ仯 �ܻ�������ƽ����Է����������ٱ仯
����ϵ��ѹǿ���ٱ仯
��5�����¶��£�ijͬѧ���������ʵ�飬���ڿո���������������Q�ı���ʽ��ʾ��
| ��ʼ n��A��/mol | ��ʼ n��B��/mol | ��ʼ n��C��/mol | ��ʼ n��D��/mol | �ﵽƽ��ʱ�ų��������գ������� |
| 0 | 1.6 | 8 | ���� | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��¯���������з�������Ҫ��ӦΪ1/3Fe2O3(s) + CO(g) 2/3Fe(s) + CO2(g)
2/3Fe(s) + CO2(g)
��֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����£�
��ش��������⣺
��1���÷�Ӧ��ƽ�ⳣ������ʽK=_____________����H________0(�>������<����=��)��
��2����һ���ݻ�Ϊ10L���ܱ������У�1000��ʱ����Fe��Fe2O3��CO��CO2��1��0 mol����Ӧ����l0 min�ﵽƽ�⡣���ʱ�䷶Χ�ڷ�Ӧ��ƽ����Ӧ���ʦ�(CO2)=" _________" ��CO��ƽ��ת����= _____________��
��3������ߣ�2����CO��ƽ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��_____________��
| A������Fe���� |
| B������Fe203���� |
| C���Ƴ�����CO2 |
| D����߷�Ӧ�¶� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ҵ���������Ҫ��Ӧ�ǣ�4NH3(g)+5O2(g) 4NO(g)+6H2O (g) ��H=" -1025" KJ/mol
4NO(g)+6H2O (g) ��H=" -1025" KJ/mol
��1��һ���¶��£��ֽ�0.8mol NH3��1.5mol O2����һ��ѹ�ܱ������У�����ʾ��ͼ��ȷ����˵����Ӧ�ﵽƽ��״̬���� 
��2�����ݻ�Ϊ1L���ܱ������з���������Ӧ�������ڲ������ʵ����ʵ���Ũ�����±���
| ʱ�䣯Ũ�� | c(NH3)(mol/L) | C(O2)(mol/L) | C(NO)(mol/L) |
| ��ʼ | 0.8 | 1.5 | 0 |
| ��2min | 0.7 | a | 0.1 |
| ��4min | 0.4 | 1.0 | 0.4 |
| ��6min | 0.4 | 1.0 | 0.4 |
| ��8min | 1.2 | 2.5 | 0.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�⼰�仯������������ռ����Ҫ��λ��
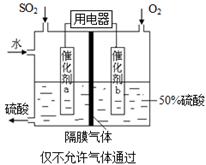
(1)�ӵ�ʳ���к��е����(KIO3)����ҵ���Ե�ⷨ�Ʊ�����أ�����豸��ͼ��ʾ���Ƚ�һ�����ĵ����ڹ�������������Һ��������Ӧ��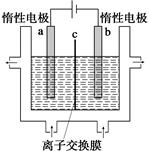
3I2��6KOH=5KI��KIO3��3H2O���ٽ�����Һ���� (����������)������������������Һ��������һ������ʹ�� (������)���ӽ���Ĥ�������������ĵ缫��Ӧʽ�� ��
(2)�⻯�ⲻ�ȶ����ֽⷴӦ���Ȼ�ѧ����ʽ��2HI(g)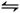 I2(g)+H2(g) ��H="+9.48" kJ��mol��1��֪��S��0
I2(g)+H2(g) ��H="+9.48" kJ��mol��1��֪��S��0
�ٸ÷�Ӧ����( )
A���κ��¶Ⱦ��Է� B���κ��¶Ⱦ����Է� C�������Է� D�������Է�
��һ�������£���Ӧ��һ�����л������ܱ������дﵽƽ�⣬����˵���в���ȷ����( )
A�����£���С�����ƽ�ⳣ������
B�����£���С�����ƽ�ⲻ�ƶ�����ɫ����
C�����ݣ����£�����Ӧ���ʺ�����Ӧ���ʾ�����
D�����ݣ�����������Ͷ��2mol HI���ﵽƽ��ʱ����9.48 kJ ������
��һ���¶��£�ƽ�ⳣ��K=1/4����2L�������У�����4molHI������Ӧ�ﵽƽ�⣬HI��ת���� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com