
在10℃时,氯酸钾的溶解度为5g,在该温度下的氯酸钾的饱和溶液中溶质、溶剂、溶液的质量比为______________.
 考前必练系列答案
考前必练系列答案科目:高中化学 来源:2014-2015学年吉林省高二上学期模块一测试化学试卷(解析版) 题型:选择题
常温时,pH值为3的CH3COOH和pH为11的NaOH溶液等体积混合,混合后溶液pH为( )
A. pH>7 B.pH< 7 C.pH=7 D.无法判断
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省高二9月月考化学试卷(解析版) 题型:填空题
味精是烹制菜肴时常用的调味品,其主要成分是谷氨酸钠(化学式为C 5 H 8 NO 4 Na)。谷氨酸钠有鲜味,易溶于水。某品牌味精包装上标注:“谷氨酸钠含量≥80%,NaCl含量<20%”。
某学校化学科研小组对此味精中NaCl的含量进行测定。
Ⅰ.查阅资料:谷氨酸钠的存在不影响NaCl含量的测定。
Ⅱ.设计实验方案:
(1)实验原理:通过味精与硝酸银反应生成氯化银的质量计算该味精中NaCl的质量分数。
(2)实验试剂:水、AgNO 3 溶液等
(3)实验过程:
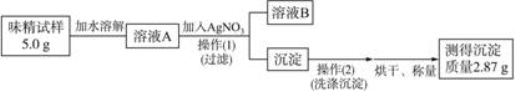
①操作(Ⅰ)所需要的玻璃仪器有____________________。
②通过计算判断该味精中NaCl的质量分数是__________,判断该味精中NaCl __________(填“符合”或“不符合”)其包装上标注的标准。
③若溶液A的体积为50 mL,则其中NaCl的物质的量浓度为____________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省高一入学摸底考试化学试卷(解析版) 题型:计算题
某校化学兴趣小组为测定空气中二氧化硫的含量,用NaOH溶液吸收SO2 ,反应方程式如下:
2NaOH+SO2 ==Na2SO3 + H2O
用NaOH溶液吸收1000L已除去CO 2 的空气样品,溶液质量增重了0.64g,已知此时空气的密度约为1.3g/L,求:
(1)被吸收的SO 2 质量. (2)发生反应的NaOH的质量.
(3)空气中SO2的质量分数(计算结果精确到0.01%) .
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省高一入学摸底考试化学试卷(解析版) 题型:填空题
现有盐酸、熟石灰、烧碱、食盐四种物质,其中能用于金属除锈的是__________________,能用于改良酸性土壤的是__________________.
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省高一入学摸底考试化学试卷(解析版) 题型:选择题
下列说法中不正确的是( )
A.可燃物遇到氧气不一定燃烧 B.缓慢氧化不一定能引起自燃
C.自燃不一定由缓慢氧化引起 D.剧烈燃烧不一定引起爆炸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省高一入学摸底考试化学试卷(解析版) 题型:选择题
冬天用煤火取暖时,容易使人中毒的是( )
A.一氧化碳 B.二氧化碳 C.二氧化硫 D.碳氢化合物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林延边州汪清六中上第一次月考高一化学试卷(解析版) 题型:选择题
(3分)1mol?L﹣1硫酸溶液的含义是( )
A. 1L水中含有1mol硫酸 B. 1L溶液中含1mol H+
C.将98g硫酸溶于1L水所配成的溶液 D. 指1L硫酸溶液中含有98g H2SO4
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市高二上第一次质量检测化学试卷(解析版) 题型:填空题
在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出该反应的热化学方程式__________________________________________。
(2)已知H2O(l)====H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是________________________。
(4)已知 N2(g)+2O2(g)====2 NO2(g);△H=+67.7 kJ·mol-1,
N2H4 (g) +O2 (g) = N2(g) +2H2O (g) △H = -543kJ/mol
根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式________________________________。
(5)已知: N2 (g) + 2O2 (g) = 2NO2 (g) △H = + 67.7kJ/mol
N2H4 (g) +O2 (g) = N2(g) +2H2O (g) △H = -543kJ/mol
1/2H2 (g) + 1/2F2 (g) = HF (g) △H = -269kJ/mol
H2 (g) + 1/2O2 (g) = H2O (g) △H = -242kJ/mol
有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的
热化学方程式: ________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com