
【题目】利用右图装置探究铁在海水中的电化学防护,下列说法不正确的是( ) 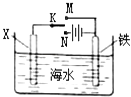
A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀
B.若X为锌棒,开关K置于M处,铁电极的反应:Fe﹣2e﹣→Fe2+
C.若X为碳棒,开关K置于N处,可减缓铁的腐蚀
D.若X为碳棒,开关K置于N处,铁电极的反应:2H++2e﹣→H2↑
【答案】B
【解析】解:A、若X为锌棒,开关K置于M处,形成原电池,此时金属锌为负极,金属铁为正极,金属铁被保护,可减缓铁的腐蚀,故A正确;B、若X为锌棒,开关K置于M处,形成原电池,此时金属锌为负极,金属铁为正极,氧气在该极发生还原反应,故B错误;
C、若X为碳棒,开关K置于N处,形成电解池,此时金属铁为阴极,铁被保护,可减缓铁的腐蚀,故C正确;
D、若X为碳棒,开关K置于N处,形成电解池,X极为阳极,发生氧化反应,铁电极为阴极,发生还原反应,故D正确.
故选B.
根据金属的防护,若K置于N处,必须让被保护的金属接电源负极;若开关K置于M处,形成原电池,锌作负极,金属铁为正极,金属铁被保护.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】“水煤气(CO、H2)﹣空气”燃料电池的工作原理如图所示,其中a、b均
为惰性电极.下列叙述正确的是( )
A.甲处通入的是空气,乙处通入的是水煤气
B.a电极发生还原反应,b电极发生氧化反应
C.用该电池电镀铜,若待镀金属增重6.4g,至少消耗标准状况下的水煤气2.24L
D.a电极的反应式包括:CO+4OH﹣+2e﹣═CO32﹣+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验室仅有如下仪器或用品:烧杯、铁架台、铁圈、三脚架、漏斗、分液漏斗、石棉网、酒精灯、玻璃棒、量筒、蒸发皿、圆底烧瓶、火柴。从缺乏仪器或用品的角度看,不能进行的实验项目是( )
A.蒸发
B.萃取
C.液体过滤
D.升华
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在A1C13和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的体积和所得沉淀的物质的量的关系如图所示(b处NaOH的体积为l L)
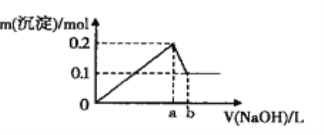
则下列判断正确的是
A. 图中线段oa:ab=3:l B. NaOH溶液物质的量浓度为0.6 mol·L-1
C. 在b点处溶液中的溶质只有NaAlO2 D. 混合溶液中Al3+与Mg2+物质的量比值为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨、硫、氯及其化合物对环境有着重要的影响,在化工生产和日常生活中的用途也十分广泛,如用做漂白剂、沉淀剂、农药、化肥等.
(1)以N2 和H2 为原料合成氢气的反应为:N2(g)+3H2(g)2NH3(g)△H=QkJ.mol﹣1 . 已知N﹣N 键键能为946kJ.mol﹣1 , H﹣H键键能为436kJ.mol ﹣1 , N﹣H键键能为391kJ.mol﹣1 , 则Q= .
(2)将体积均为560mL(标准状况下)的SO2 和Cl2 同时缓慢通水中,得到1.0L溶液,则溶液pH= .
(3)物质的量浓度相等的NH4HSO3溶液和NaHSO3溶液中,阴离子的电离程度较小的是(填化学式),原因是
(4)用惰性电极电解NaHSO3 溶液的装置如图所示,则I是(填化学式,下同),阳极区放出的混合气体的成分为 . 
(5)氨水是一种常见的沉淀剂.向1.0L2.0×10﹣4mol.L﹣1的MgCl2 溶液中通入 (不考虑溶液体积的变化),有白色沉淀生成.
①写出生成白色沉淀的离子方程式
②当反应中开始有白色沉淀出现时,通人的体积(标准状况)为 mL.(已知实验条件下NH3 . H2O的电离平衡常数为1.8×l0﹣5 , Ksp[Mg(OH)2]=1.8×10﹣11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知,Fe2+结合S2﹣的能力大于结合OH﹣的能力,而Al3+则正好相反.在Fe2(SO4)3和AlCl3的混合溶液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得沉淀是( )
A.Al2S3、FeS和S
B.Fe(OH)3和Al(OH)3
C.Fe2S3和Al(OH)3
D.FeS、Al(OH)3和S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类合理的是( )
A. 氧化物:CO2、NO、SO2、H2O B. 碱:NaOH、KOH、Ba(OH)2、Na2CO3
C. 铵盐:NH4Cl、NH4NO3、NH3·H2O D. 碱性氧化物:Na2O、CaO、CO2、Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含铬化合物的废水有毒,特别是Cr(Ⅵ)有致癌作用,对农作物及微生物的毒害很大.目前处理的方法较多,还原沉淀法是较为广泛的处理含铬废水的方法,流程如图: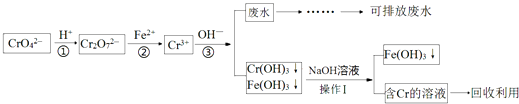
(1)步骤①中存在平衡:2CrO42﹣(黄色)+2H+Cr2O72﹣(橙色)+H2O该反应的平衡常数表达式K=;碱性溶液中Cr(Ⅵ)离子的颜色呈 . (填“黄色”或“橙色”)
(2)上述操作Ⅰ的名称为 , 以下物质可用于代替步骤②中的Fe2+的是
A.KMnO4(H+) B.HNO3 C.Na2SO3
(3)步骤③中出水总铬与溶液的pH关系如图,下列说法不正确的是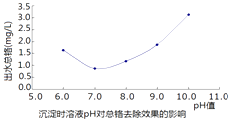
A.为有效除去Cr3+ , 加入的碱越多越好
B.Cr(OH)3可溶于强碱
C.要除去Cr3+ , 调节pH值最好为7左右
(4)已知Ksp[Cr(OH)3]=1.1×10﹣32 , 按《污水综合排放标准》,水质中总铬的浓度应小于3×10﹣5molL﹣1 , 当步骤③调节pH=6时,该处理后的污水是否达到排放标准?(填“是”或“否”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工农业生产、生活中有着重要作用.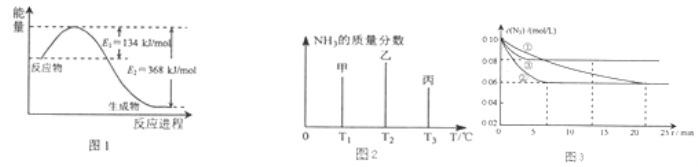
(1)图1是1molNO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式 .
(2)在固定容积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1 用一定物质的量的N2和H2合成NH3 , 三个容器的反应温度分别为T1、T2、T3且恒定不变,在其它条件相同的情况下,实验测得反应均进行到t min时NH3的质量分数如图2所示:
此时甲、乙、丙三个容器中一定达到化学平衡状态的是容器,都达到平衡状态时,NH3的质量分数最高的是容器(填甲、乙、丙).
图3是实验室在三个不同条件的密闭容器中,分别加入浓度均为c(N2)=0.10mol/L,c(H2)=0.26mol/L进行反应时,N2的浓度随时间的变化如图①、②、③曲线所示.
Ⅰ该反应实验②平衡时H2的转化率为 .
Ⅱ据图3所示,②装置中有一个条件与①不同,请指出②相对①改变的条件 .
Ⅲ计算实验③的平衡常数为 .
(3)铜与一定浓度硝酸反应时方程式可表示为:Cu+HNO3一Cu(NO3)2+NO+NO2+H2O(方程式未配平).3.2g Cu被硝酸完全溶解后,如果得到的NO和NO2物质的量相同,则得到标准状况下NO体积为 L.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com