
����Ŀ���������ȼ��仯����Ի���������Ҫ��Ӱ�죬�ڻ����������ճ������е���;Ҳʮ�ֹ㷺��������Ư������������ũҩ�����ʵȣ�
��1����N2 ��H2 Ϊԭ�Ϻϳ������ķ�ӦΪ��N2��g��+3H2��g��2NH3��g����H=QkJ��mol��1 �� ��֪N��N ������Ϊ946kJ��mol��1 �� H��H������Ϊ436kJ��mol ��1 �� N��H������Ϊ391kJ��mol��1 �� ��Q= ��
��2���������Ϊ560mL����״���£���SO2 ��Cl2 ͬʱ����ͨˮ�У��õ�1.0L��Һ������ҺpH= ��
��3�����ʵ���Ũ����ȵ�NH4HSO3��Һ��NaHSO3��Һ�У������ӵĵ���̶Ƚ�С�������ѧʽ����ԭ����
��4���ö��Ե缫���NaHSO3 ��Һ��װ����ͼ��ʾ����I�����ѧʽ����ͬ�����������ų��Ļ������ijɷ�Ϊ �� 
��5����ˮ��һ�ֳ����ij���������1.0L2.0��10��4mol��L��1��MgCl2 ��Һ��ͨ�� ����������Һ����ı仯�����а�ɫ�������ɣ�
��д�����ɰ�ɫ���������ӷ���ʽ
�ڵ���Ӧ�п�ʼ�а�ɫ��������ʱ��ͨ�˵��������״����Ϊ mL������֪ʵ��������NH3 �� H2O�ĵ���ƽ�ⳣ��Ϊ1.8��l0��5 �� Ksp[Mg��OH��2]=1.8��10��11��
���𰸡�
��1����92
��2��1
��3��NH4HSO3��笠�����ˮ������ԣ�����������������ӵĵ���
��4��Na2SO3��O2��SO2
��5��Mg2++2NH3?H2O=Mg��OH��2��+2NH4+��118.72
���������⣺(1)��H=��Ӧ��ļ���֮�ͩ�������ļ���֮��=��946kJ��mol��1��+3����436kJ��mol ��1����6����391kJ��mol��1��=��92kJ��mol��1 ��
���Դ��ǣ���92��
��2.��n��SO2��=n��Cl2��= ![]() =0.025mol��
=0.025mol��
�����SO2��Cl2 ͬʱ����ͨˮ�з���Cl2+SO2+2H2O=H2SO4+2HCl��������n��H+��=0.025mol��4=0.1mol��c��H+��= ![]() =0.1mol/L��
=0.1mol/L��
pH=��lg0.1=1��
���Դ��ǣ�1��
��3.��NH4HSO3��Һ笠�����ˮ������ԣ�����������������ӵĵ��룬�������ӵĵ���̶Ƚ�С����NH4HSO3 ��
���Դ��ǣ�NH4HSO3��笠�����ˮ������ԣ�����������������ӵĵ��룻
��4.����������������ͬʱ����OH�� �� ��NaHSO3��Һ��Ӧ����Na2SO3 �� ��������������ͬʱ����H+ �� ��NaHSO3��Ӧ����SO2 ��
���Դ��ǣ�Na2SO3��O2��SO2��
��5.���ٰ�ˮ��Һ�ʼ��ԣ���MgCl2 ��Һ��Ӧ����������þ��������Ӧ�����ӷ���ʽΪMg2++2NH3H2O=Mg��OH��2��+2NH4+ ��
���Դ��ǣ�Mg2++2NH3H2O=Mg��OH��2��+2NH4+��
�ڿ�ʼ�а�ɫ��������ʱ��c��OH����= ![]() mol/L=3��l0��4mol/L��
mol/L=3��l0��4mol/L��
��ϰ�ˮ�ĵ���ƽ�ⳣ��= ![]() =
= ![]() =1.8��l0��5 �� c��NH3 �� H2O��=5��l0��3mol/L��
=1.8��l0��5 �� c��NH3 �� H2O��=5��l0��3mol/L��
δ����ǰc��NH3 �� H2O��=5��l0��3mol/L+3��l0��4mol/L=5.3��l0��3mol/L��
n��NH3��=5.3��l0��3mol��
ͨ�백�������=5.3��l0��3mol/L��22.4L/mol=0.11872L=118.72mL��
���Դ��ǣ�118.72��
�����㾫����������Ŀ����֪���������÷�Ӧ�Ⱥ��ʱ�����֪ʶ���Եõ�����Ĵ𰸣���Ҫ�����ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ�ȣ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ȣ�SO2Cl2����һ����Ҫ�Ļ����Լ���ʵ���Һϳ������ȵ�ʵ��װ����ͼ��ʾ����֪����SO2��g��+Cl2��g��SO2Cl2��l��+Q��Q��0��
�������ȳ�����Ϊ��ɫҺ�壬�۵�Ϊ��54.1�棬�е�Ϊ69.1�棬�ڳ�ʪ�����С����̡���
��100�����ϻ�ʱ���������ȶ��ֽ⣬���ɶ��������������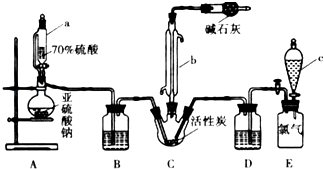
��1������aΪ��ѹ��Һ©��������ͨ��Һ©����ȣ����ŵ��� ��
��2��װ��C�и�������ʯ�������� �� װ��EΪ����װ�ã������ṩ��������װ��E���ų�����1.12L��������ɱ�״����ʱ�����յõ�5.4g�����������ȣ��������ȵIJ���Ϊ �� Ϊ��������ȵIJ��ʣ���ʵ������л���Ҫע���������
��3����Ӧ������Cװ����������ƿ��Ļ����ֿ���ʵ������� �� �Ȼ��ᣨClSO3H�����ȷֽ⣬Ҳ���Ƶ�������������һ�����ʣ��÷�Ӧ�Ļ�ѧ����ʽ
��4������SO2��Cl2����һ������ͨ��ˮ�У�����Ƽ�ʵ����֤�����Ƿ�ǡ����ȫ��Ӧ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʢ��KI��Һ���Թ��У�����������ˮ��ַ�Ӧ���ټ����Ȼ�̼�����ú�۲쵽��������(����)
A.�ϲ��Ϻ�ɫ���²�ӽ���ɫ
B.���ȡ������Ϻ�ɫ
C.���ȡ�������ɫ
D.�ϲ�ӽ���ɫ���²��Ϻ�ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������д������(����)
A.��������ʱ��Ӧʹ������е�ˮ����ȫ���ɺ���ֹͣ����
B.�������ʱ��Ӧʹ�¶ȼ�ˮ����������ƿ��֧�ܿڴ�
C.��Һ����ʱ����Һ©�����²�Һ����¿ڷų����ϲ�Һ����Ͽڵ���
D.��ȡ����ʱ��Ӧѡ���л���ȡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС�鰴����ʵ������̽�������е⺬���IJⶨ�͵����ȡ��ʵ��һ���⺬���IJⶨ
ȡ0.0100mol/L��AgNO3����Һ�ζ�100.00mL������ȡԭҺ���õ��Ƶζ����ⶨ��ĺ�������õĵ綯�ƣ�E����ӳ��Һ��C��I���� �仯�������ִ��������Ƴ��ζ����������߱仯���£�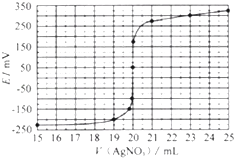
ʵ����������ȡ
��ȡ������ȡԭҺ���ס�������ʵ�鷽�����£�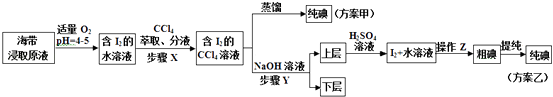
��֪��3I2+6NaOH��5NaI+NaIO3+3H2O
��ش�
��1��ʵ��һ�е��������ƣ�����A �� ����B��ʵ����в���Z������ ��
��2�����ݱ������߿�֪���˴εζ��յ�ʱ��ȥAgNO3��Һ�����Ϊml������ú����е�İٷֺ���Ϊ ��
��3������X�У���ȡ���Һ©���ڹ۲쵽�������� ��
��4�������йز���Y��˵������ȷ����A��Ӧ����NaOH��Һ��Ũ�Ⱥ���� B������ת�������ӽ���ˮ��
C����Ҫ�dz�ȥ������ȡԭҺ�е��л����� D��NaOH��Һ�������Ҵ�����
�������У��ϲ�Һ������ᷢ����Ӧ�����ӷ���ʽ�� ��
��5������������������������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼװ��̽�����ں�ˮ�еĵ绯ѧ����������˵������ȷ���ǣ� �� 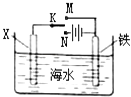
A.��XΪп��������K����M�����ɼ������ĸ�ʴ
B.��XΪп��������K����M�������缫�ķ�Ӧ��Fe��2e����Fe2+
C.��XΪ̼��������K����N�����ɼ������ĸ�ʴ
D.��XΪ̼��������K����N�������缫�ķ�Ӧ��2H++2e����H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��PbO2���ȷֽ�ΪPb��+4��+2�۵Ļ�������+4�۵�Pb������Ũ��������Cl2���ֽ�1mol PbO2���ȷֽ�õ�O2 �� ��ʣ������м���������Ũ����õ�Cl2 �� O2��Cl2�����ʵ���֮��Ϊ1��1����ʣ��������ɼ����ʵ����ȿ����ǣ� ��
A.1��2��1��ϵ�PbO2��Pb3O4��PbO
B.1��3��2��ϵ�PbO2��Pb3O4��PbO
C.1��1��1��ϵ�PbO2��Pb3O4��PbO
D.2��1��1��ϵ�PbO2��Pb3O4��PbO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������з�����ӦN2O4��g��2NO2��g����H=+57kJmol��1 �� ���¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ������˵����ȷ���ǣ� �� 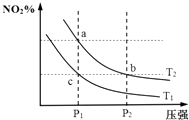
A.��Ӧ�¶ȣ�T1��T2
B.a��b�����ƽ�ⳣ����Kb��Ka
C.a��c�����������ɫ��adz��c��
D.b��c����ķ�Ӧ���ʣ�v��b����v��c��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ�����淴Ӧ��2A��g��+B��g��2C��g����H��0��ͼ����ȷ���ǣ� ��
A.
B.
C.
D.
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com