
【题目】某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取.实验一:碘含量的测定
取0.0100mol/L的AgNO3标准溶液滴定100.00mL海带浸取原液,用电势滴定法测定碘的含量.测得的电动势(E)反映溶液中C(I﹣) 变化,用数字传感器绘制出滴定过程中曲线变化如下: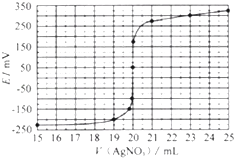
实验二:碘的制取
另取海带浸取原液,甲、乙两种实验方案如下: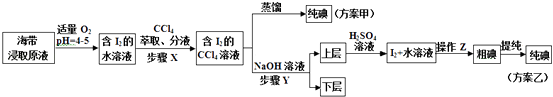
已知:3I2+6NaOH→5NaI+NaIO3+3H2O
请回答:
(1)实验一中的仪器名称:仪器A , 仪器B;实验二中操作Z的名称 .
(2)根据表中曲线可知:此次滴定终点时用去AgNO3溶液的体积为ml,计算该海带中碘的百分含量为 .
(3)步骤X中,萃取后分液漏斗内观察到的现象是 .
(4)下列有关步骤Y的说法,正确的是A.应控制NaOH溶液的浓度和体积 B.将碘转化成离子进入水层
C.主要是除去海带浸取原液中的有机杂质 D.NaOH溶液可以由乙醇代替
方案乙中,上层液体加硫酸发生反应的离子方程式是 .
(5)方案甲中采用蒸馏不合理,理由是 .
【答案】
(1)坩埚;500ml容量瓶;过滤
(2)20.00;0.635%
(3)液体分上下两层,下层呈紫红色
(4)AB;5I﹣+IO3﹣+6H+=3I2+3H2O
(5)碘单质易升华,会导致碘损失
【解析】解:(1)根据仪器的构造可知,用于灼烧海带的仪器为坩埚;通过仪器B配制500mL含有碘离子的浸取液,需要使用500mL的容量瓶,步骤Z将碘单质和水分离,由于碘单质不溶于水,可通过过滤操作完成,所以答案是:坩埚;500mL容量瓶;过滤;(2)根据滴定曲线可知,当加入20mL硝酸银溶液时,电动势出现了突变,说明滴定终点时消耗了20.00mL硝酸银溶液; ![]() ,20.00mL硝酸银溶液中含有硝酸银的物质的量为:0.0100mol/L×0.02L=0.0002mol,则500mL原浸出液完全反应消耗硝酸银的物质的量为:0.0002mol×
,20.00mL硝酸银溶液中含有硝酸银的物质的量为:0.0100mol/L×0.02L=0.0002mol,则500mL原浸出液完全反应消耗硝酸银的物质的量为:0.0002mol× ![]() =0.001mol,说明20.00g该海带中含有0.001mol碘离子,所以海带中碘的百分含量为:
=0.001mol,说明20.00g该海带中含有0.001mol碘离子,所以海带中碘的百分含量为: ![]() ×100%=0.635%,所以答案是:20.00;0.635%;(3)碘单质易溶于有机溶剂,微溶于水,且四氯化碳的密度大于水溶液,所以步骤X向含有碘单质的水溶液中加入四氯化碳后,混合液会分为上下两层,下层为四氯化碳的碘溶液,则下层呈紫红色,所以答案是:液体分为上下两层,下层呈紫红色;(4)A.发生反应3I2+6NaOH═5NaI+NaIO3+3H2O中,需要浓氢氧化钠溶液,所以应控制NaOH溶液的浓度和体积,故A正确;B.根据反应3I2+6NaOH═5NaI+NaIO3+3H2O可知,步骤Y将碘转化成离子进入水层,故B正确;C.该操作的主要目的是将碘单质转化成碘酸钠、碘化钠,将碘转化成离子进入水层,不是除去有机杂质,故C错误;D.乙醇易溶于水和四氯化碳,将氢氧化钠换成乙醇,仍然无法分离出碘单质,故D错误;在酸性条件下,I﹣和IO3﹣反应生成I2,发生反应的离子方程式为5I﹣+IO3﹣+6H+=3I2+3H2O,所以答案是:AB;5I﹣+IO3﹣+6H+→3I2+3H2O;(5)方案甲中采用蒸馏操作,由于碘单质容易升华,会导致碘单质损失,所以甲方案不合理,所以答案是:碘单质易升华,会导致碘损失.
×100%=0.635%,所以答案是:20.00;0.635%;(3)碘单质易溶于有机溶剂,微溶于水,且四氯化碳的密度大于水溶液,所以步骤X向含有碘单质的水溶液中加入四氯化碳后,混合液会分为上下两层,下层为四氯化碳的碘溶液,则下层呈紫红色,所以答案是:液体分为上下两层,下层呈紫红色;(4)A.发生反应3I2+6NaOH═5NaI+NaIO3+3H2O中,需要浓氢氧化钠溶液,所以应控制NaOH溶液的浓度和体积,故A正确;B.根据反应3I2+6NaOH═5NaI+NaIO3+3H2O可知,步骤Y将碘转化成离子进入水层,故B正确;C.该操作的主要目的是将碘单质转化成碘酸钠、碘化钠,将碘转化成离子进入水层,不是除去有机杂质,故C错误;D.乙醇易溶于水和四氯化碳,将氢氧化钠换成乙醇,仍然无法分离出碘单质,故D错误;在酸性条件下,I﹣和IO3﹣反应生成I2,发生反应的离子方程式为5I﹣+IO3﹣+6H+=3I2+3H2O,所以答案是:AB;5I﹣+IO3﹣+6H+→3I2+3H2O;(5)方案甲中采用蒸馏操作,由于碘单质容易升华,会导致碘单质损失,所以甲方案不合理,所以答案是:碘单质易升华,会导致碘损失.


科目:高中化学 来源: 题型:
【题目】写出下列物质在水溶液中的电离方程式
(1)氯化镁_________________________ (2)硫酸氢钠_____________________
(3)碳酸氢钠 _____________________ (4)硫酸铝______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤化工可制得甲醇.以下是合成聚合物M的路线图.
己知:①E、F均能发生银镜反应;② ![]() +RX
+RX ![]()
![]() +HX完成下列填空:
+HX完成下列填空:
(1)关于甲醇说法错误的是(选填序号).a.甲醇可发生取代、氧化、消去等反应 b.甲醇可以产生CH3OCH3(乙醚)
c.甲醇有毒性,可使人双目失明 d.甲醇与乙醇属于同系物
(2)甲醇转化为E的化学方程式为 .
(3)C生成D的反应类型是; 写出G的结构简式 .
(4)取1.08gA物质(式量108)与足量饱和溴水完全反应能生成2.66g白色沉淀,写出A的结构简式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物其结构简式为 ![]() ,关于该有机物下列叙述正确的是( )
,关于该有机物下列叙述正确的是( )
A.分子式为C13H18Cl
B.能使酸性KMnO4溶液褪色,但不能使溴水褪色
C.在加热和催化剂作用下,最多能和3mol H2反应
D.该分子中能通过聚合反应生成高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列混合物分离提纯方法正确的有 ( )
①用萃取法分离溴化钠和单质溴的水溶液 ②用过滤法分离Fe(OH)3胶体和FeCl3溶液的混合物 ③用结晶法提纯混有NaCl的KNO3
A.①②③
B.①③
C.②③
D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨、硫、氯及其化合物对环境有着重要的影响,在化工生产和日常生活中的用途也十分广泛,如用做漂白剂、沉淀剂、农药、化肥等.
(1)以N2 和H2 为原料合成氢气的反应为:N2(g)+3H2(g)2NH3(g)△H=QkJ.mol﹣1 . 已知N﹣N 键键能为946kJ.mol﹣1 , H﹣H键键能为436kJ.mol ﹣1 , N﹣H键键能为391kJ.mol﹣1 , 则Q= .
(2)将体积均为560mL(标准状况下)的SO2 和Cl2 同时缓慢通水中,得到1.0L溶液,则溶液pH= .
(3)物质的量浓度相等的NH4HSO3溶液和NaHSO3溶液中,阴离子的电离程度较小的是(填化学式),原因是
(4)用惰性电极电解NaHSO3 溶液的装置如图所示,则I是(填化学式,下同),阳极区放出的混合气体的成分为 . 
(5)氨水是一种常见的沉淀剂.向1.0L2.0×10﹣4mol.L﹣1的MgCl2 溶液中通入 (不考虑溶液体积的变化),有白色沉淀生成.
①写出生成白色沉淀的离子方程式
②当反应中开始有白色沉淀出现时,通人的体积(标准状况)为 mL.(已知实验条件下NH3 . H2O的电离平衡常数为1.8×l0﹣5 , Ksp[Mg(OH)2]=1.8×10﹣11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列八种物质: HCl、NH4Cl、N2、Na2O2、CaCl2、Cl2、NaF、CO2。
(1)只含有离子键的物质是______(填化学式,下同)。
(2)既含有离子键,又含有共价键的物质是______。
(3)属于共价化合物的是____,其中所有原子都满足8电子结构的是_____。
(4)写出NaF的电子式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应H2(g)+Br2(g)=2HBr(g)△H=﹣83kJmol﹣1 , 1molH2(g)、1molBr2(g) 分子中化学键断裂时分别需要吸收436kJ、193kJ的能量,则断开1molHBr(g) 分子中化学键需吸收的能量为( )
A.566kJ
B.283kJ
C.712kJ
D.356kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验误差分析错误的是( )
A.用润湿的pH试纸测稀碱溶液的pH,测定值偏小
B.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C.滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D.测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com