
工业上采用乙苯与CO2脱氢生产重要化工原料苯乙烯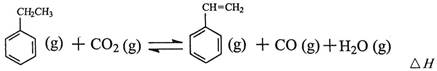
其中乙苯在CO2气氛中的反应可分两步进行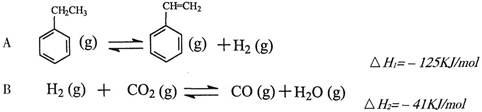
(1)上述乙苯与CO2反应的反应热△H为________________________。
(2)①乙苯与CO2反应的平衡常数表达式为:K=______________________。
②下列叙述不能说明乙苯与CO2反应已达到平衡状态的是_____________________。
a.v正(CO)=v逆(CO) b.c(CO2)=c(CO)
c.消耗1mol CO2同时生成1molH2O d.CO2的体积分数保持不变
(3)在3L密闭容器内,乙苯与CO2的反应在三种不同的条件下进行实验,乙苯、CO2的起始浓度分别为1.0mol/L和3.0mol/L,其中实验I在T1℃、0.3MPa,而实验II、III分别改变了实验其他条件;乙苯的浓度随时间的变化如图I所示。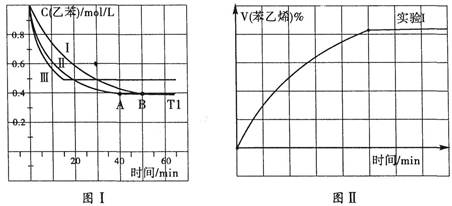
①实验I乙苯在0~50min时的反应速率为_______________。
②实验II可能改变条件的是__________________________。
③图II是实验I中苯乙烯体积分数V%随时间t的变化曲线,请在图II中补画实验Ⅲ中苯乙烯体积分数V%随时间t的变化曲线。
(4)若实验I中将乙苯的起始浓度改为1.2mol/L,其他条件不变,乙苯的转化率将(填“增大”、“减小”或“不变”),计算此时平衡常数为_____________________。
(16分)(1)-166kJ/mol(2分)
(2)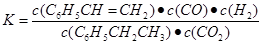 bc(每空2分 共4分)
bc(每空2分 共4分)
(3)①0.012mol/(L?min) ②加入催化剂
③ (每空2分共6分)
(每空2分共6分)
(4)减小(2分) 0.225 (2分)
解析试题分析:(1)观察三个热化学方程式,发现已知焓变的A+B可以得到乙苯与二氧化碳的反应,根据盖斯定律,则乙苯与二氧化碳反应的焓变=△H1+△H2=[(—125)+(—41)]kJ/mol=—166kJ/mol;(2)①观察乙苯与二氧化碳反应的化学方程式,发现各组分都是气体,系数都是1,则该反应的平衡常数K=[c(C6H5CH=CH2)?c(CO) ?c(H2O)]/[c(C6H5CH2CH3) ?c(CO2)];②同一种物质表示的正反应速率等于逆反应速率,说明已达平衡,故a错误;虽然各组分的变化浓度之比等于化学方程式中系数之比,但是各组分的平衡浓度之比不一定等于化学方程式中系数之比,因此二氧化碳和一氧化碳浓度相等时反应不一定达到平衡,故b正确;二氧化碳和水的系数之比等于1∶1,消耗1molCO2同时生成1molH2O,说明不同物质的正反应速率等于化学方程式中系数之比,缺少逆反应速率,因此不能说明达到平衡,故c正确;二氧化碳是反应物,其体积分数逐渐减小,若保持不变,说明反应已达平衡,故d错误;(3)①观察图I,0~50min内△c(乙苯)=(1.0—0.4)mol/L=0.6mol/L,由于v=△c/△t,则v(乙苯)= 0.6mol/L÷50min=0.012mol/(L?min);②对比图I、图II,发现I→II时,单位时间内乙苯的变化浓度增大,说明反应速率加快,但是平衡时乙苯的浓度相等,说明平衡没有移动;由于乙苯与二氧化碳的反应是气体体积增大的放热反应,根据浓度、压强、温度和催化剂对化学平衡的影响规律推断,实验II可能改变的条件是加入催化剂;③同理,推断实验I→III时,反应速率增大,平衡向逆反应方向移动,说明改变的条件是升高温度,因此画出的曲线满足以下几个要点:起点与实验I相同,未达平衡前,实验III的反应速率比I大,平衡后苯乙烯的体积分数比实验I的小;(4)增大乙苯的浓度,虽然平衡右移,乙苯的变化浓度增大,但是乙苯的起始浓度也增大,且变化浓度增大的程度小于起始浓度增大的程度,因此乙苯的转化率减小;平衡常数只与温度有关,与浓度改变无关,因此实验I中各组分的平衡浓度计算出的平衡常数就是此时的平衡常数,依题意可知实验I反应中各组分的起始、变化、平衡浓度,则:
C6H5CH2CH3(g)+CO2(g)  C6H5CH=CH2(g)+CO(g)+H2O(g)
C6H5CH=CH2(g)+CO(g)+H2O(g)
起始浓度/ mol?Lˉ1 1.0 3.0 0 0 0
变化浓度/ mol?Lˉ1 0.6 0.6 0.6 0.6 0.6
平衡浓度/ mol?Lˉ1 0.4 2.4 0.6 0.6 0.6
K=[c(C6H5CH=CH2)?c(CO) ?c(H2O)]/[c(C6H5CH2CH3) ?c(CO2)]="(" 0.6×0.6×0.6)/( 0.4×2.4)=0.225。
考点:考查化学反应大题,涉及盖斯定律、平衡常数表达式、化学平衡状态、平均反应速率、外界条件对化学反应速率和化学平衡的影响、化学反应速率和化学平衡图像、平衡常数计算等。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) △H= -28.5 kJ·(mol-1
2Fe(s)+3CO2(g) △H= -28.5 kJ·(mol-1
(1)已知:C(石墨)+CO2(g) 2CO(g) △H=" +" 172.5 kJ·mol-1
2CO(g) △H=" +" 172.5 kJ·mol-1
则反应:Fe2O3(S) +3C(石墨) 2Fe(s)+3CO(g) △H= kJ·mol-1
2Fe(s)+3CO(g) △H= kJ·mol-1
(2)冶炼铁反应 Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) △H=-28.5 kJ·mol-1的平衡常数表达式K= ,温度降低后,K值 .(填“增大”、“不变”或“减小”)。
2Fe(s)+3CO2(g) △H=-28.5 kJ·mol-1的平衡常数表达式K= ,温度降低后,K值 .(填“增大”、“不变”或“减小”)。
(3)在ToC时,该反应的平衡常数K=27,在1L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
| | Fe2 O3 | CO | Fe | CO2 |
| 甲容器 | 1.0 mol | 1.0 mol | 1.0 mol | 1.0 mol |
| 乙容器 | 1.0 mol | 2.0 mol | 1.0 mol | 1.0 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(12分) (1)已知:蒸发1 mol Br2(l)需要吸收的能量为 30 kJ,其他相关数据如下表:
| 物质 | H2(g) | Br2(g) | HBr(g) |
| 1 mol分子中化学键断裂时需要吸收的能量/kJ | 436 | 200 | 369 |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
依据事实,写出下列反应的热化学方程式。
(1)1molC2H4(g)与适量O2(g)反应生成CO2(g)和H2O(l),放出1411kJ热量。
(2)1molC2H5OH(l)与适量O2(g)反应生成CO2(g)和H2O(l),放出1366.8kJ热量。
(3)2molAl(s)与适量O2(g)反应生成Al2O3(s),放出1669.8kJ热量。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1= +489.0 kJ/mol
C(石墨)+CO2(g)=2CO(g) ΔH2=+172.5 kJ/mol
则CO还原Fe2O3的热化学方程式为 ;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO。PdCl2被还原成单质,反应的化学方程式为 ;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2构成丙烷燃料电池。
①负极电极反应式是: ;
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 (填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)  CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有铁、镁等离子)制备BaCl2·2H2O,工艺流程如下: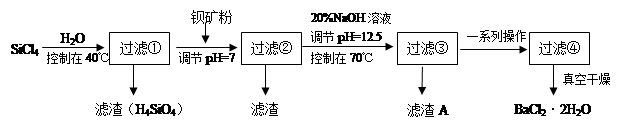
已知:
①常温下Fe3+、Mg2+完全沉淀的pH分别是3.4、12.4
②BaCO3的相对分子质量是197;BaCl2·2H2O的相对分子质量是244
回答下列问题:
(1)SiCl4发生水解反应的化学方程式为_______________________________________
(2)用H2还原SiCl4蒸汽可制取纯度很高的硅,当反应中有1mol电子转移时吸收59KJ热量,则该反 应的热化学方程式为_____________________________________________
(3)加钡矿粉并调节pH=7的目的是① ,②
(4)过滤②后的滤液中Fe3+浓度为 (滤液温度25℃,Ksp[Fe(OH)3]=2.2×10-38)
(5)生成滤渣A的离子方程式__________________________________________
(6)列式计算出10吨含78.8% BaCO3的钡矿粉理论上最多能生成BaCl2·2H2O的质量为多少吨?
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
I.高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s) + 3CO(g) 2Fe(s)+3CO2(g) △H
2Fe(s)+3CO2(g) △H
(1)已知:①Fe2O3(s) + 3C(石墨)="2Fe(s)" + 3CO(g) △H1
②C(石墨)+ CO2(g) = 2CO(g) △H2
则△H___________________(用含△H1 、△H2的代数式表示)。
(2)高炉炼铁反应的平衡常数表达式K=____________________________。
(3)在某温度时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| | Fe2O3 | CO | Fe | CO2 |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
| 编号 | 温度/K | 反应时间/h | 反应物物质的量配比 | 实验目的 |
| ① | 378 | 4 | 3∶1 | 实验②和④探究________ ______________________ 实验②和__________探究 反应时间对产率的影响。 |
| ② | 378 | 4 | 4∶1 | |
| ③ | 378 | 3 | _______ | |
| ④ | 398 | 4 | 4∶1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
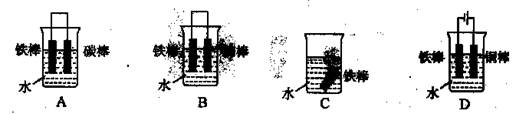
50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应的反应热。
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 。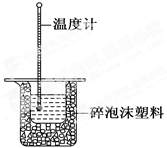
(2)烧杯间填满碎泡沫塑料的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和反应的反应热的数值 (填“偏大” “偏小”或“无影响”)。
(4)实验中改用55 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”)。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和反应的反应热数值会 (填“偏大”“偏小”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于化学反应限度的说法中正确的是( )
| A.当一个可逆反应达到平衡状态时,就是这个反应在该条件下所能达到的限度 |
| B.当一个可逆反应进行到平衡状态时,这个反应的正向反应速率和逆向反应速率为零 |
| C.平衡状态是一种静止的状态,因为反应物和生成物的浓度不再改变 |
| D.化学反应的限度不可以通过改变条件而发生改变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com