
下列关于化学反应限度的说法中正确的是( )
| A.当一个可逆反应达到平衡状态时,就是这个反应在该条件下所能达到的限度 |
| B.当一个可逆反应进行到平衡状态时,这个反应的正向反应速率和逆向反应速率为零 |
| C.平衡状态是一种静止的状态,因为反应物和生成物的浓度不再改变 |
| D.化学反应的限度不可以通过改变条件而发生改变 |
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:计算题
工业上采用乙苯与CO2脱氢生产重要化工原料苯乙烯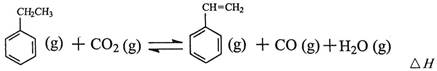
其中乙苯在CO2气氛中的反应可分两步进行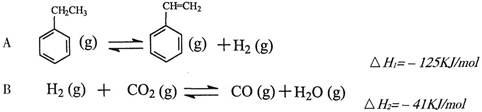
(1)上述乙苯与CO2反应的反应热△H为________________________。
(2)①乙苯与CO2反应的平衡常数表达式为:K=______________________。
②下列叙述不能说明乙苯与CO2反应已达到平衡状态的是_____________________。
a.v正(CO)=v逆(CO) b.c(CO2)=c(CO)
c.消耗1mol CO2同时生成1molH2O d.CO2的体积分数保持不变
(3)在3L密闭容器内,乙苯与CO2的反应在三种不同的条件下进行实验,乙苯、CO2的起始浓度分别为1.0mol/L和3.0mol/L,其中实验I在T1℃、0.3MPa,而实验II、III分别改变了实验其他条件;乙苯的浓度随时间的变化如图I所示。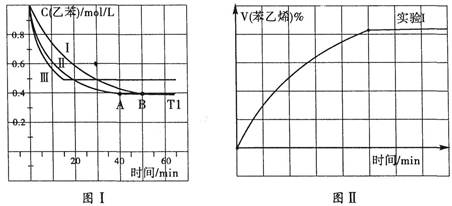
①实验I乙苯在0~50min时的反应速率为_______________。
②实验II可能改变条件的是__________________________。
③图II是实验I中苯乙烯体积分数V%随时间t的变化曲线,请在图II中补画实验Ⅲ中苯乙烯体积分数V%随时间t的变化曲线。
(4)若实验I中将乙苯的起始浓度改为1.2mol/L,其他条件不变,乙苯的转化率将(填“增大”、“减小”或“不变”),计算此时平衡常数为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
反应3X(g)+Y(g) 2Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.5mol,则此反应的平均速率υ为( )
2Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.5mol,则此反应的平均速率υ为( )
| A.υ(X)=0.05mol·L—1·min—1 | B.υ(Y)= 0.10mol·L—1·min—1 |
| C.υ(Z)=0.10mol·L—1·min—1 | D.υ(W)=0.05mol·L—1·s—1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知反应A2(g)+2B2(g) 2AB2(g)△H <0,下列说法正确的
2AB2(g)△H <0,下列说法正确的
| A.升高温度,正向反应速率增加,逆向反应速率减小 |
| B.升高温度有利于反应速率增加,从而缩短达到平衡的时间 |
| C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 |
| D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
t℃时,在体积不变的容器中发生反应X(g)+3Y(g) 2Z(g)△H<O各组分浓度如下表
2Z(g)△H<O各组分浓度如下表
| 物质 | X | Y | Z |
| 初始浓度/ mol·L-1 | 0.1 | 0.3 | 0 |
| 2min末浓度/mol·L-1 | 0.08 | | |
| 平衡浓度/mol·L-1 | | | 0.1 |
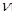 逆碱小,平衡正向移动
逆碱小,平衡正向移动查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一定条件下,反应N2+3H2 2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为:
2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为:
| A.v(NH3)="0.1" mol/(L·min) | B.v(N2)="0.02" mol/(L·min) |
| C.v(H2)="0.015" mol/(L·min) | D.v(NH3)="0.17" mol/(L·min) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) △H =" +" 74.9 kJ·mol-1,下列说法中正确的是
| A.该反应中熵变、焓变皆大于0 |
| B.该反应是吸热反应,因此一定不能自发进行 |
| C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行 |
| D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定量的锌粉和6mol·L—1的过量盐酸反应,当向其中加入少量的下列物质:①石墨 ②CuO ③铜粉 ④锌粒 ⑤浓盐酸 ⑥无水乙酸 ⑦KNO3溶液 ⑧CuCl2时,能够加快反应速率,又不响产生H2总量的是 ( )
| A.①③④ | B.②④⑧ | C.①③⑤ | D.①⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
工业制硫酸中的一步重要反应是SO2在400~500℃下的催化氧化:2SO2+ O2 2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是( )
2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是( )
| A.使用催化剂是为了加快反应速率,提高生产效率 |
| B.在上述条件下,SO2不可能100%地转化为SO3 |
| C.为了提高SO2的转化率,应适当提高O2的浓度 |
| D.达到平衡时,SO2的浓度与SO3的浓度相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com