
̼��̼�Ļ������������������е�Ӧ�÷dz��㷺�����ᳫ���������ѳɳ����Ľ��죬����̼�������ֻ��һ�����룬����һ��ֵ���ڴ����µ����ʽ��
��1����CO2�뽹̿��������CO��CO�����������ȡ�
����֪��Fe2O3(s)��3C(ʯī)��2Fe(s)��3CO(g) ��H1�� +489.0 kJ/mol
C(ʯī)��CO2(g)��2CO(g) ��H2��+172.5 kJ/mol
��CO��ԭFe2O3���Ȼ�ѧ����ʽΪ ��
���Ȼ��٣�PdCl2����Һ����Ӧ���ڼ���������CO��PdCl2����ԭ�ɵ��ʣ���Ӧ�Ļ�ѧ����ʽΪ ��
��2��������ʯī�缫����KOH��Һ�У��������ֱ�ͨ��C3H8��O2���ɱ���ȼ�ϵ�ء�
�ٸ����缫��Ӧʽ�ǣ� ��
��ijͬѧ���ñ���ȼ�ϵ�������һ�ֵ�ⷨ��ȡFe(OH)2��ʵ��װ�ã�����ͼ��ʾ����ͨ�����Һ�в��������İ�ɫ�������ҽϳ�ʱ�䲻��ɫ������˵������ȷ���� ������ţ�
A����Դ�е�aһ��Ϊ������bһ��Ϊ����
B��������NaCl��Һ��Ϊ���Һ
C��A��B���˶������������缫
D�����������ķ�Ӧ�ǣ�2H+��2e����H2��
��3������ͬ����CO(g)��H2O(g)�ֱ�ͨ�����Ϊ2L�ĺ����ܱ������У����з�Ӧ��CO(g)��H2O(g)  CO2(g)��H2(g)���õ������������ݣ�
CO2(g)��H2(g)���õ������������ݣ�
| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
��1����Fe2O3(s)��3CO(g)��2Fe(s)��3CO2(g) ��H����28.5kJ/mol
��PdCl2��CO��H2O��Pd��CO2��2HCl
��2����C3H8��20e-��26OH-��3CO32-��17H2O ��BD
��3���� ���� �� K��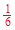 ��ʹ���˴������Ӵ���ѹǿ
��ʹ���˴������Ӵ���ѹǿ
��4��c(Na+)��c(HCO3-)��c(CO32-)��c(OH-)��c(H+)
���������������1���ٽ���һ������ʽ��ȥ3���ĵڶ�������ʽ�ɵ�Ŀ�귽��ʽ����Ӧ������Ӧ�ı仯�ļ��ɡ�
��Pd����ԭ����CO������ΪCO2������ԭ���غ㻹Ӧ��H2O���뷴Ӧ����һ�ֲ���ΪHCl��
��2���ٵ��ԭ���DZ���ȼ�գ����ɵ�CO2����KOH��Ӧ����̼���Ρ�ȼ�ϵ��ͨ��ȼ�ϱ����һ���Ǹ�������˸����ĵ缫��ӦʽΪC3H8��20e-��26OH-��3CO32-��17H2O��
���õ�ⷨ�Ʊ�Fe(OH)2������������Fe���缫��ӦʽΪFe-2e��=Fe2+��������Һ�е�H+�ŵ磬�缫��ӦʽΪ2H++2e��=H2��������ʿ���NaCl��Һ����Ӧ����H2��ʹ�����ﴦ�ڻ�ԭ��Χ�У����A��B����������������
��3����ʵ��2��ʵ��1��ȣ������ʵ����ʵ�������һ�룬ƽ��CO2ӦΪ0.8mol�����¶����ߣ���ʱCO2��Ϊ0.4mol��˵�������¶�ƽ�������ƶ����淴Ӧ���ȣ�������ӦΪ���ȷ�Ӧ��
�ڸ��������У�CO(g)��H2O(g)  CO2(g)��H2(g)
CO2(g)��H2(g)
��ʼ��/mol 1 2 0 0
�仯��/mol 0.4 0.4 0.4 0.4
ƽ����/mol 0.6 1.6 0.4 0.4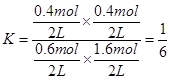
��ʵ��3��ʵ��2��ȣ�ƽ��״̬δ�䣬����Ӧ���ʼӿ죬��˸ı�����������Ǽ������������ѹǿ��
��4���������������ĸ����ʵ����ʵ�������֪��Ӧ�����õ��ǵ����ʵ�����Na2CO3��NaHCO3�Ļ����Һ��CO32-��HCO3-ˮ��ʹ��Һ�Լ��ԣ���CO32-��ˮ��̶ȴ���HCO3-�������Һ�и����ӵ����ʵ���Ũ���ɴ�С��˳��Ϊc(Na+)��c(HCO3-)��c(CO32-)��c(OH-)��c(H+)��
���㣺�����˹���ɣ����أ��缫��Ӧʽ��д��Ӱ�컯ѧƽ�����أ���ѧƽ�ⳣ�����ε�ˮ��ȡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���Ṥҵ�Ļ����ǰ��Ĵ��������ڴ��������·������·�Ӧ��
�� 4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ��H =" ��905" kJ/mol ������Ӧ
4NO(g)+6H2O(g) ��H =" ��905" kJ/mol ������Ӧ
�� 4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ��H =" ��1268" kJ/mol �ڸ���Ӧ
2N2(g)+6H2O(g) ��H =" ��1268" kJ/mol �ڸ���Ӧ
�й����ʲ������¶ȵĹ�ϵ���ͼ��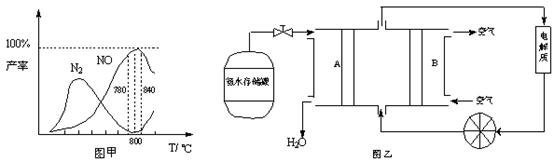
��1���ɷ�Ӧ�٢ڿ�֪��Ӧ��N2(g) + O2(g) 2NO(g)�ķ�Ӧ�Ȧ�H=
2NO(g)�ķ�Ӧ�Ȧ�H=
��2����ͼ��֪��ҵ�ϰ����������� NOʱ����Ӧ�¶���ÿ�����
��3����Fe3O4�Ʊ�Fe��NO3��3��Һʱ����ӹ�����ϡ���ᣬԭ��һ����Fe4O3�е�Fe2+ȫ��ת��ΪFe3+��
ԭ����� �������ֺ����ӷ���ʽ˵������
��4����NH3ͨ��NaClO��Һ�У�������N2H4����Ӧ�����ӷ���ʽΪ ��
��5�����ݷ�Ӧ�ڿ�����Ƴ�ֱ�ӹ���ʽ����ȼ�ϵ�أ�����ͼ��ʾ������ͼ��AΪ ��������������������缫����ʽΪ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��15�֣���1��25��ʱ��0��1 mol��L��1��HA��Һ��c(H+)/c(OH-)��1010����ش��������⣺
��HA��________(�ǿ����ʡ���������ʡ�)��
���ڼ�ˮϡ��HA��Һ�Ĺ����У�����ˮ�������Ӷ���С����________(����ĸ)��
A��c(H+)/c(HA)�� B��c(HA)/(A-) C��c(H��)��c(OH��)�ij˻� �� D��c(OH��)
����M��Һ��������HA��ҺV1 mL��pH = 12��NaOH��ҺV2 mL��ϳ�ַ�Ӧ���ã�������˵������ȷ����
A������ҺM�����ԣ�����ҺM��c(H+) + c(OH-) = 2��0��10-7 mol��L-1
B����V1 =V2 ������ҺM��pHһ������7
C������ҺM�����ԣ�V1һ������V2
D������ҺM�ʼ��ԣ�V1һ��С��V2
��2������֪��25�棬AgCl��Ksp = 1��8��10-10���ֽ�����AgCl�ֱ���룺��100 mL ����ˮ�У���100 mL 0��2mol��L-1 AgNO3��Һ�У���100 mL 0��1mol��L-1 AlCl3��Һ�У���100 mL 0��1mol��L-1�����У���ֽ������ͬ�¶���c(Ag+)�ɴ�С��˳���� ����������ӣ�
��3����1mol SO2(g)����Ϊ1mol SO3(g)�Ħ�H ����99kJ��mol��1���������ȼ����Ϊ296kJ��mol��1������S(s)����3 mol SO3(g)�Ħ�H =
��4������2NO2(g) N2O4(g) ��H < 0��Ӧ�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ��������˵����ȷ���� ��
N2O4(g) ��H < 0��Ӧ�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ��������˵����ȷ���� ��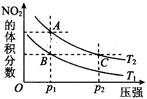
�٣�A��C����ķ�Ӧ���ʣ�A>C
�ڣ�A��C�����������ɫ��A�Cdz
�ۣ�B��C����������ƽ������������B<C
�ܣ���״̬B��״̬A�������ü��ȷ���
��5����ͼ�����ü���ȼ�ϵ�ص��50 mL 2 mol��L-1���Ȼ�ͭ��Һ��װ��ʾ��ͼ��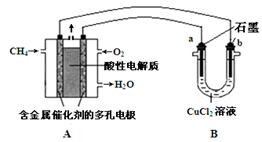
��ش�
�� ����ȼ�ϵ�صĸ�����Ӧʽ�� ��
�� ����·����0��2 mol����ͨ��ʱ����������____g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
���仯���������{�ºϽ�ҵ���������졢�{��ȼ�ϵȷ���Ӧ�ù㷺��
��1����������һ�����²��ϣ���֪��ط�Ӧ���Ȼ�ѧ����ʽ���£�
2B(s)+N2(g)= 2BN(s) ��H="a" kJ ? mol-1
B2H6 (g)=2B(s) + 3H2 (g) ��H =b kJ ? mol-1
N2 (g) + 3H2 (g) 2NH3 (g) ��H ="c" kJ? mol-1
2NH3 (g) ��H ="c" kJ? mol-1
�ٷ�ӦB2H6(g)+2NH3(g)=2BN(s)+6H2(g) ��H = (�ú�a��b��c�Ĵ���ʽ��ʾ)kJ ��mol-1��
��B2H6��һ���{��ȼ�ϣ�д������Cl2��Ӧ���������Ȼ���Ļ�ѧ����ʽ�� ��
��2�����һЩ������Ķ������������ܵ����ǵĹ�ע��
�����������ѧ�ҽ��������͵��ᷢ����̼������������ɫ���ȴ�ͳ������ᱵ������ȫ��̼�����������������Ϊ78. 6%����̼����Ļ�ѧʽΪ ��
�ڽ��������ǽ�LiBH4��LiNH2��ĥ���Ͽ��γ��µĻ�����Li3BN2H8��Li4BN3 H10��Li3BN2H8��ĥ�ǰ����ʵ���֮��n(LiNH2) : n(LiBH4) =" 2" : 1������ĥ�γɵģ���Ӧ�����е�X����ͼ����ͼ��ʾ��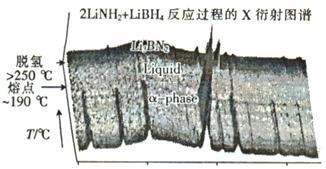
Li3BN2H8�ڴ���250��ʱ�ֽ�Ļ�ѧ����ʽΪ ��Li3BN2H8��Li4BN3H10�����ʵ�����ͬʱ����ַֽ⣬�ų�������H2��Li4BN3 H10�ֽ�ʱ�����������Li2NH����һ�����壬�������� ��
��3��ֱ�����⻯��ȼ�ϵ�ص�ԭ����ͼ�������ĵ缫��ӦʽΪ ������ܷ�Ӧ�����ӷ���ʽΪ ��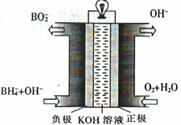
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
��ѧ��Ӧԭ���ڹ�ҵ�����о���ʮ����Ҫ�����塣
��1���ϳɰ��õ������ж�����ȡ����������д����C�Ʊ�ˮú���Ļ�ѧ��Ӧ����ʽ ������������Ȼ����������ȡ������CH4��H2O(g) ���´���CO��3H2���Ƚ��������ַ���ת��6mol����ʱ��C��CH4������֮���� ��
��2����ҵ����������NH3��g����CO2��g������������Ӧ�������أ�������Ӧ�������仯ʾ��ͼ���£�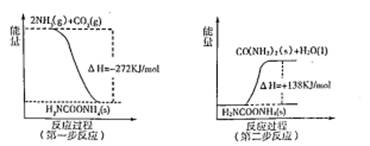
��NH3��g����CO2��g����Ӧ�������ص��Ȼ�ѧ����ʽΪ ��
��3����֪��ӦFe��s��+CO2��g����FeO��s��+CO��g�� ��H��akJ/mol������ڲ�ͬ�¶��£��÷�Ӧ��ƽ�ⳣ��K���¶ȵı仯���£�
�ٸ÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽK= ��a 0���>������<������������500��2L�ܱ������н��з�Ӧ��Fe��CO2����ʼ����Ϊ4 mol����5min��ﵽƽ��ʱCO2��ת����Ϊ ������CO��ƽ������v��CO��Ϊ ��
��700�淴Ӧ�ﵽƽ���Ҫʹ��ƽ�������ƶ���������������ʱ�����Բ�ȡ�Ĵ�ʩ�� ������ĸ����
| A����С��Ӧ���ݻ� | B������Fe�����ʵ��� |
| C�������¶ȵ�900�� | D��ʹ�ú��ʵĴ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
��ҵ�ϲ����ұ���CO2����������Ҫ����ԭ�ϱ���ϩ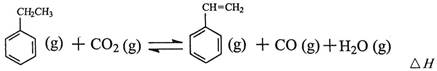
�����ұ���CO2�����еķ�Ӧ�ɷ���������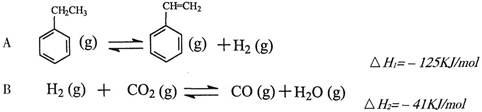
��1�������ұ���CO2��Ӧ�ķ�Ӧ�ȡ�HΪ________________________��
��2�����ұ���CO2��Ӧ��ƽ�ⳣ������ʽΪ��K=______________________��
��������������˵���ұ���CO2��Ӧ�Ѵﵽƽ��״̬����_____________________��
a��v��(CO)=v��(CO) b��c(CO2)=c(CO)
c������1mol CO2ͬʱ����1molH2O d��CO2������������ֲ���
��3����3L�ܱ������ڣ��ұ���CO2�ķ�Ӧ�����ֲ�ͬ�������½���ʵ�飬�ұ���CO2����ʼŨ�ȷֱ�Ϊ1.0mol/L��3.0mol/L������ʵ��I��T1�桢0.3MPa����ʵ��II��III�ֱ�ı���ʵ�������������ұ���Ũ����ʱ��ı仯��ͼI��ʾ��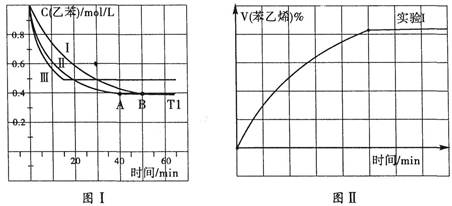
��ʵ��I�ұ���0��50minʱ�ķ�Ӧ����Ϊ_______________��
��ʵ��II���ܸı���������__________________________��
��ͼII��ʵ��I�б���ϩ�������V%��ʱ��t�ı仯���ߣ�����ͼII�в���ʵ����б���ϩ�������V%��ʱ��t�ı仯���ߡ�
��4����ʵ��I�н��ұ�����ʼŨ�ȸ�Ϊ1.2mol/L�������������䣬�ұ���ת���ʽ������������С�����䡱���������ʱƽ�ⳣ��Ϊ_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
)�������ڹ�ҵ�������й㷺����;��
��1��SO2�����ڹ�ҵ����SO3��
����һ�������£�ÿ����8g SO3���壬����9.83kJ���÷�Ӧ���Ȼ�ѧ����ʽΪ__________________
����500�棬�������ڵ������£����ݻ�Ϊ1L�ļס��������ܱ������о�����2 mol SO2��1 mol O2���ױ���ѹǿ���䣬�ұ����ݻ����䣬��ַ�Ӧ����ﵽƽ�⡣
I��ƽ��ʱ����������SO3��������Ĺ�ϵΪ����_______�ң��>������<���� =������
II��������t1 minʱ�ﵽƽ�⣬��ʱ�����������SO2��ת����Ϊ90%����÷�Ӧ��ƽ�ⳣ��Ϊ_______�������¶Ȳ��䣬t2 minʱ����������г���1 mol SO2��1 mol SO3��t3 minʱ�ﵽ��ƽ�⡣������ͼ�л���t2~t4min�����淴Ӧ���ʵı仯���ߣ������ϱ������V���� V����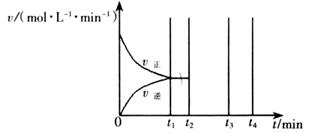
��2������þ���壨MgSO4��7H2O )���Ƹҽҩ��������й㷺��;��4.92g����þ����������ˮ���̵��������ߣ������������¶ȱ仯�����ߣ�����ͼ��ʾ��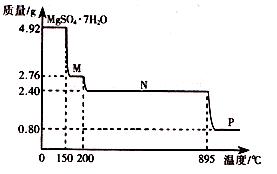
�ٹ���M�Ļ�ѧʽΪ__________��
������þ��������ʧȥ�ᾧˮ�Ĺ��̷�Ϊ_________���Ρ�
��Nת����Pʱ��ͬʱ������һ��������÷�Ӧ�Ļ�ѧ����ʽΪ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
������ͼ��ʾװ�òⶨ�к��ȵ�ʵ�鲽�����£�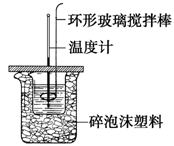
����һ������Ͳ��ȡ50ml 0.50 mol?L��1���ᵹ��С�ձ��У���������¶�t1��
�����������һ��Ͳ��ȡ50ml 0.55 mol?L��1 NaOH��Һ��������һ�¶ȼƲ�����¶�t2��
����������NaOH��Һ����С�ձ��У��跨ʹ֮��Ͼ��ȣ���û��Һ����¶�t3��
�ش��������⣺
��1���������е���NaOH��Һ����ȷ������__________��
A���ز������������� B���������������� C��һ��Ѹ�ٵ���
��2��ʹ������NaOH��Һ��Ͼ��ȵ���ȷ������________������ţ���
A����������ձ� B���ҿ�ӲֽƬ�ò���������
C�����¶ȼ�С�Ľ��� D���������¶ȼ��ϵĻ��β������������ؽ���
��3��___________����ܡ����ܡ�����Ba��OH��2��Һ���������NaOH��Һ��������к��ȣ�������________________________________________��
��4���ڷ�Ӧ������Ϊ�з��������������HCl�ڷ�Ӧ�лӷ������õ��к���_______���ƫ����ƫС�����䡱����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
t��ʱ�����������������з�����ӦX(g)+3Y(g) 2Z(g)��H<O�����Ũ�����±�
2Z(g)��H<O�����Ũ�����±�
| ���� | X | Y | Z |
| ��ʼŨ��/ mol��L-1 | 0.1 | 0.3 | 0 |
| 2minĩŨ��/mol��L-1 | 0.08 | | |
| ƽ��Ũ��/mol��L-1 | | | 0.1 |
 ����С��ƽ�������ƶ�
����С��ƽ�������ƶ��鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com