
【题目】如图是实验室制备氯气并验证氯气性质的装置(其中夹持装置已省略)。
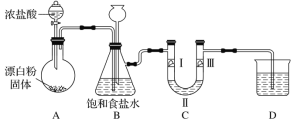
已知:装置A是氯气的发生装置,反应的化学方程式为Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O。据此回答下列问题:
(1)装置B中饱和食盐水的作用是________;长颈漏斗的作用是__________。
(2)装置C的作用是验证氯气是否具有漂白性,则装置C中Ⅰ、Ⅱ、Ⅲ处依次应放入的物质是: 湿润的有色布条、 无水氯化钙、干燥的有色布条,请你推测Ⅰ、Ⅲ处的现象依次为:______,_____。
(3)装置D的作用是___________,则烧杯中的溶液是______,写出所发生反应的化学方程式: ________。
【答案】除去Cl2中的HCl,降低Cl2在水中的溶解度 监测实验进行时装置C中是否发生堵塞 有色布条褪色 无变化 吸收多余的氯气,防止污染环境 浓NaOH溶液(合理即可) Cl2+2NaOH=NaCl+NaClO+H2O
【解析】
(1)浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢在饱和食盐水中溶解度较大,氯气在饱和食盐水中溶解度不大;据监测实验进行时C中是否发生堵塞,发生堵塞时B中的压强增大来分析;
(2)验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性;
(3) 据氯气有毒不能直接排放到空气中,应用碱吸收来分析。
(1)制备的氯气中含有氯化氢,氯化氢在饱和食盐水中溶解度较大,氯气在饱和食盐水中溶解度不大,所以可以用B中饱和食盐水吸收氯气中的氯化氢;监测实验进行时C中是否发生堵塞,发生堵塞时B中的,压强增大,气体将溶液压入长颈漏斗B中,形成水柱;
故答案为:除去Cl2中的HCl,降低Cl2在水中的溶解度;监测实验进行时装置C中是否发生堵塞;
(2)装置C的实验目的是验证氯气是否具有漂白性,验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,因为C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,
故答案:有色布条褪色;无变化;
(3)氯气有毒不能直接排放到空气中,故D的作用是吸收多余的氯气,防止污染空气,氯气是酸性气体,故用碱液NaOH溶液吸收,氯气与氢氧化钠反应生产氯化钠,次氯酸钠和水,反应为Cl2+2NaOH=NaCl+NaClO+H2O;
故答案为: 吸收多余的氯气,防止污染环境;浓NaOH溶液(合理即可);Cl2+2NaOH=NaCl+NaClO+H2O。


科目:高中化学 来源: 题型:
【题目】已知T℃时AgCl的Ksp=2×1010;Ag2CrO4是一种橙红色固体,T℃时在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
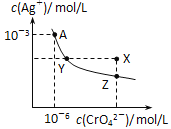
A. T℃时Ag2CrO4的Ksp=1×108
B. Y和Z点Ag2CrO4的Ksp不相同
C. 在饱和Ag2CrO4溶液中加入K2CrO4固体可使溶液由Y点到X点
D. 浓度均为2×106molL﹣1AgNO3与NaCl溶液等体积混合无沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,二氧化碳作氧化剂的是( )
A.Ca(OH)2+CO2=CaCO3↓+H2O
B.CO2+C![]() 2CO
2CO
C.2Fe2O3+3C![]() 4Fe+3CO2↑
4Fe+3CO2↑
D.C+2H2O(g)![]() 2H2+CO2
2H2+CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有化学纯的浓硫酸,其试剂瓶标签上的部分内容如下图:

请回答下列问题:
(1)配制溶液时,一般可以分为以下几个主要步骤:
①量取 ②计算 ③溶解 ④定容 ⑤转移 ⑥洗涤 ⑦装瓶,其正确的操作顺序为___________(填序号)。
(2)实验室只有100mL、250mL、500mL三种规格的容量瓶,但要配制480 mL 0.50 mol/L的稀硫酸,需取该浓硫酸______mL。
(3)接下来完成此实验你将用到的仪器有20mL量筒、烧杯、玻璃棒、____________。
(4)要从所配溶液中取出50 mL盛装于试剂瓶中,给它贴上标签,则标签的内容是________________;若再从中取出10 mL溶液稀释至20 mL,则稀释后溶液的物质的量浓度为__________。
(5)下列操作会使所配溶液浓度偏低的是__________。
A. 用量筒量取浓硫酸,读数时仰视刻度线 B. 转移溶液时未洗涤烧杯
C. 容量瓶用蒸馏水洗净后仍残留有蒸馏水 D. 定容时俯视容量瓶的刻度线
E. 定容摇匀后,发现液面低于刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.5molCO2中含有_______个CO2分子,_______mol氧原子, ______个碳原子,CO2的质量为__________ g,标况下体积为_________ L。![]() 11.1g的ACl2中含有0.2molCl-,ACl2的物质的量是__________,ACl2的摩尔质量是__________,A的相对原子质量是________。
11.1g的ACl2中含有0.2molCl-,ACl2的物质的量是__________,ACl2的摩尔质量是__________,A的相对原子质量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的前四周期元素,X、Z的周期序数=族序数,由这四种元素组成的单质或化合物存在如图所示的转化关系,其中甲、戊是两常见的金属单质,丁是非金属单质,其余为氧化物且丙为具有磁性的黑色晶体。下列说法正确的是
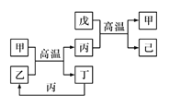
A. W的原子序数是Z的两倍,金属性强于Z
B. W元素在周期表中的位置是第四周期VIII族
C. 丙属于两性氧化物
D. 等物质的量的甲和戊完全溶于稀硝酸,消耗的HNO3的量一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将![]() mL 1mo/L
mL 1mo/L ![]() 和
和![]() mL 1mo/L
mL 1mo/L ![]() 两种酸溶液分别加水稀释,稀释溶液体积为V,稀释液pH与其体积变化的关系如图所示。下列说法正确的是
两种酸溶液分别加水稀释,稀释溶液体积为V,稀释液pH与其体积变化的关系如图所示。下列说法正确的是
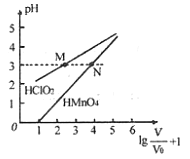
A. ![]() 和
和![]() 均为一元弱酸
均为一元弱酸
B. 在0≤pH≤5时,![]() 溶液满足
溶液满足![]()
C. 分别往M、N两点对应溶液中滴加1 mo/L NaOH溶液至恰好完全反应,消耗NaOH溶液的体积相等
D. 常温下,浓度均为0.1 mo/L的![]() 和
和![]() 溶液,溶液pH:
溶液,溶液pH:![]() >
>![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | 85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸点/℃ | 60.3 | 444.6 | 10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态O原子的电子排布图为_______,基态O原子电子占据最高能级的电子云轮廓图为____形,O原子最外层电子的运动状态有_____种。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是______________。
(3)图(a)为S8的结构,该分子中S原子的杂化轨道类型为______________。其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为_____________。
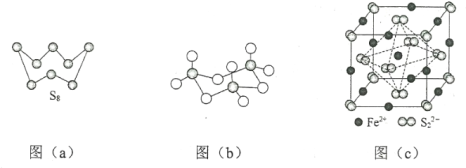
(4)气态三氧化硫以单分子形式存在,其分子中共价键的类型有_______种(根据成键的方式);固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的价层电子数___________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞中有Fe2+_____个,有S22-_____个,晶胞中Fe2+位于S22-所形成的_____的体心。
(6)酸性H2SO4 __________H2SO3(填 “>”或 “<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A是农药生产中的一种中间体,其结构简式如图,下列叙述不正确的是( )
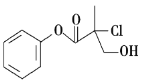
A. 有机物A属于芳香族化合物
B. 有机物A和NaOH的醇溶液共热可发生消去反应
C. 有机物A和浓硫酸混合加热,可以发生消去反应
D. 1molA和足量的NaOH溶液反应,最多可以消耗 3molNaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com