
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | 85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸点/℃ | 60.3 | 444.6 | 10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态O原子的电子排布图为_______,基态O原子电子占据最高能级的电子云轮廓图为____形,O原子最外层电子的运动状态有_____种。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是______________。
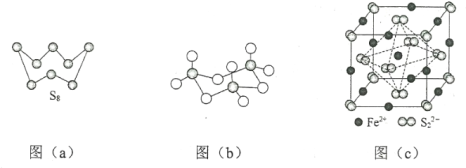
(3)图(a)为S8的结构,该分子中S原子的杂化轨道类型为______________。其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为_____________。
(4)气态三氧化硫以单分子形式存在,其分子中共价键的类型有_______种(根据成键的方式);固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的价层电子数___________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞中有Fe2+_____个,有S22-_____个,晶胞中Fe2+位于S22-所形成的_____的体心。
(6)酸性H2SO4 __________H2SO3(填 “>”或 “<”)。
【答案】 哑铃(纺锤) 6 H2S sp3 S8相对分子质量大,分子间范德华力强 2 4 4 4 正八面体 >
哑铃(纺锤) 6 H2S sp3 S8相对分子质量大,分子间范德华力强 2 4 4 4 正八面体 >
【解析】
(1)依据O基态原子的核外电子排布式解答;
(2)根据价层电子对互斥理论分析;
(3)先结合图(a)的成键数目即孤电子对数判断出其杂化类型,再根据影响S8分子晶体熔沸点高低的是范德华力判断;
(4)三氧化硫分子中存在硫氧双键,据此判断共价键类型;结合图(b)成键数目分析作答;
(5)利用均摊法对晶胞中离子个数进行分析;结合几何关系回答;
(6)对于同种元素的含氧酸来说,该元素的化合价越高,其含氧酸的酸性越强,据此作答。
(1)基态O原子的核外电子排布式为1s22s22p,4,则其核外电子的电子排布图为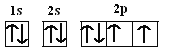 ;根据电子排布式可知,电子占据最高能级是2p,其电子云轮廓图为哑铃(纺锤)形;不同的电子运动状态均不相同,因O原子最外层电子为6个,则电子运动状态有6种,
;根据电子排布式可知,电子占据最高能级是2p,其电子云轮廓图为哑铃(纺锤)形;不同的电子运动状态均不相同,因O原子最外层电子为6个,则电子运动状态有6种,
故答案为: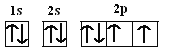 ;哑铃(纺锤)形;6;
;哑铃(纺锤)形;6;
(2)根据价层电子对互斥理论可知H2S、SO2、SO3的气态分子中,中心原子价层电子对数分别是![]() ,因此不同其他分子的是H2S,
,因此不同其他分子的是H2S,
故答案为:H2S;
(3)S8、二氧化硫形成的晶体均是分子晶体,根据图(a)可以看出一个S周围有两个S原子成键,S原子还有2个孤电子对,结合杂化轨道理论可知,该分子中S原子的杂化轨道类型为sp3;由于S8相对分子质量大,范德华力强,所以其熔点和沸点要比二氧化硫的熔点和沸点高很多,
故答案为:sp3;S8相对分子质量大,分子间范德华力强;
(4)气态三氧化硫以单分子形式存在,分子中存在硫氧双键,因此其中共价键的类型有2种,即σ键、π键;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子形成4个共价键,其价层电子对数为4,
故答案为:2;4;
(5)根据晶胞结构可知含有铁原子的个数是12×![]() +1=4,S22-个数是8×
+1=4,S22-个数是8×![]() +6×
+6×![]() =4,根据图中几何关系可知,晶胞中Fe2+位于S22-所形成的正八面体的体心,
=4,根据图中几何关系可知,晶胞中Fe2+位于S22-所形成的正八面体的体心,
故答案为:4;4;正八面体;
(6)对于同种元素的含氧酸来说,该元素的化合价越高,其含氧酸的酸性越强,则酸性H2SO4>H2SO3,
故答案为:>。


 核心素养学练评系列答案
核心素养学练评系列答案科目:高中化学 来源: 题型:
【题目】下列事实不能说明元素的金属性或非金属性相对强弱的是
序号 | 事实 | 推论 |
A | 与冷水反应,Na比Mg剧烈 | 金属性:Na > Mg |
B | Ca(OH)2的碱性强于Mg(OH)2 | 金属性:Ca > Mg |
C | SO2与NaHCO3溶液反应生成CO2 | 非金属性:S > C |
D | t℃时,Br2+H2 I2+H2 | 非金属性:Br > I |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室制备氯气并验证氯气性质的装置(其中夹持装置已省略)。
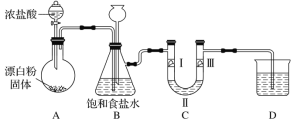
已知:装置A是氯气的发生装置,反应的化学方程式为Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O。据此回答下列问题:
(1)装置B中饱和食盐水的作用是________;长颈漏斗的作用是__________。
(2)装置C的作用是验证氯气是否具有漂白性,则装置C中Ⅰ、Ⅱ、Ⅲ处依次应放入的物质是: 湿润的有色布条、 无水氯化钙、干燥的有色布条,请你推测Ⅰ、Ⅲ处的现象依次为:______,_____。
(3)装置D的作用是___________,则烧杯中的溶液是______,写出所发生反应的化学方程式: ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面有关化学反应速率和限度的图像和实验结论表达均正确的是( )
A.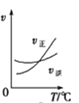 A(g)+3B(g)2C(g),如图是其他条件一定时反应速率随温度变化的图像,图像表明,较低温度下升温平衡逆向移动,较高温度下升温平衡正向移动
A(g)+3B(g)2C(g),如图是其他条件一定时反应速率随温度变化的图像,图像表明,较低温度下升温平衡逆向移动,较高温度下升温平衡正向移动
B.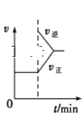 FeCl3+3KSCNFe(SCN)3+3KCl,如图是在平衡体系的溶液中加入少量KCl晶体后化学反应速率随时间的变化
FeCl3+3KSCNFe(SCN)3+3KCl,如图是在平衡体系的溶液中加入少量KCl晶体后化学反应速率随时间的变化
C.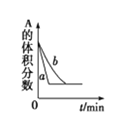 A(g)+3B(g)2C(g),如图可能是催化剂对化学平衡的影响,也可能是其它因素对化学平衡的影响
A(g)+3B(g)2C(g),如图可能是催化剂对化学平衡的影响,也可能是其它因素对化学平衡的影响
D.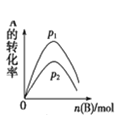 A(g)+3B(g)2C(g),如图是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p2
A(g)+3B(g)2C(g),如图是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物J是一种防止血管中血栓形成与发展的药物,其合成路线如图所示(部分反应条件略去)。
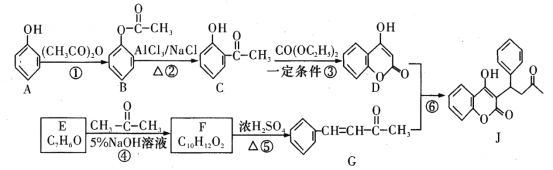
请回答下列问题:
(1)B的名称为______________,反应⑥的反应类型是__________。
(2)J含有_______种官能团。F的结构简式是_____________。
(3)反应③的化学方程式为____________________________________________-。
(4)写出同时满足下列条件的F的同分异构体的结构简式:______________(至少写两种)。
①苯环上只有两个处于对位的取代基;
②1 mol该有机物能与含2 mol NaOH的溶液恰好完全反应。
(5)参照D的合成路线,设计一种以![]() 为原料制备
为原料制备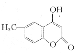 的合成路线__________。
的合成路线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | 85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸点/℃ | 60.3 | 444.6 | 10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为__________,基态S原子电子占据最高能级的电子云轮廓图为_________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是_________。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________。
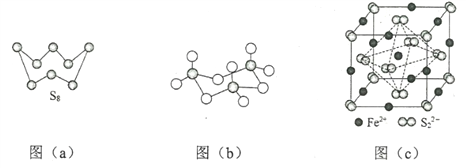
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为_____形,其中共价键的类型有______种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为______nm。
所形成的正八面体的体心,该正八面体的边长为______nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列四种微粒:①![]() 、②
、②![]() 、③
、③![]() 、④
、④![]()
(1)按原子半径由大到小顺序排列的是________________________(用序号回答,下同)
(2)微粒中质子数小于中子数的是______________________________
(3)在化合物中呈现的化合价的数值最多的是____________________
(4)能形成X2Y2型化合物的是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)[化学——选修5:有机化学基础]
近来有报道,碘代化合物E与化合物H在Cr-Ni催化下可以发生偶联反应,合成一种多官能团的化合物Y,其合成路线如下:

已知:![]()
回答下列问题:
(1)A的化学名称是________________。
(2)B为单氯代烃,由B生成C的化学方程式为________________。
(3)由A生成B、G生成H的反应类型分别是________________、________________。
(4)D的结构简式为________________。
(5)Y中含氧官能团的名称为________________。
(6)E与F在Cr-Ni催化下也可以发生偶联反应,产物的结构简式为________________。
(7)X与D互为同分异构体,且具有完全相同官能团。X的核磁共振氢谱显示三种不同化学环境的氢,其峰面积之比为3∶3∶2。写出3种符合上述条件的X的结构简式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗盐中含Ca2+、Mg2+、Fe3+、SO42—等杂质,需要提纯后才能综合利用。为除去粗盐中的杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
![]()
(1)提纯的步骤有:①加入过量的Na2CO3溶液②加入过量的BaCl2溶液③加入过量的NaOH溶液④调节溶液的pH等于7⑤溶解⑥过滤⑦蒸发,正确的操作顺序是________(填选项字母)。
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦ c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
(2)操作Z的名称是_____,蒸发操作用到的仪器有酒精灯,玻璃棒,三脚架,泥三角还有 ________。
(3)第Ⅱ步中,写出除去Ca2+和Fe3+相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2,Fe3+的主要存在形式为FeCl3)____________________、____________________。
(4)判断SO42—已沉淀完全的方法是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com