
【题目】下列实验能获得成功的是
A.140℃时,无水乙醇与浓硫酸共热可制备乙烯
B.往油脂中加稀硫酸与之共热可发生皂化反应
C.检验淀粉是否水解完全,可往水解液中加碘溶液观察是否变蓝
D.验证溴乙烷中的溴元素,可直接加AgNO3溶液观察是否有淡黄色沉淀生成
科目:高中化学 来源: 题型:
【题目】电解质在溶液中的行为是化学研究的重要内容。下列有关溶液的叙述不正确的是
A.加热蒸干NaCl、MgCl2溶液时可以得到晶体NaCl、MgCl2
B.相同条件下,等物质的量浓度的溶液导电能力:HC1>NH3·H2O
C.溶液中离子结合质子(氢离子)的能力:C2O42—>HC2O4—>SO42—
D.海洋封存CO2会导致局部海洋水体酸性增强,会破坏海洋生态环境
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸。下图是工业上用印刷电路的蚀刻液的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程:

按要求回答下列问题:
⑴ 废液①的主要含有的金属阳离子是__________(填化学符号,下同);废渣①的成分是_____________,Y为__________。
⑵废液①与Z反应的离子方程式为:______________________。
⑶ 写出废渣②生成二氧化硫的化学方程式_____________________。
⑷ 为得到纯净的CuCl晶体,可用下列_________(填序号)进行洗涤。
a.纯净水 b.乙醇 c.稀硫酸 d.氯化铜溶液
⑸ 生产过程中调节溶液的pH不能过大的原因是___________________。
⑹ 写出产生CuCl的离子方程式_______________________。
⑺ 氯化亚铜的定量分析:
① 称取样品0.25g加入10mL过量的FeCl3溶液250mlL锥形瓶中,不断摇动;
② 待样品溶解后,加水50mL和2滴指示剂;
③ 立即用0.10 mol·L-1硫酸铈标准溶液滴至绿色出现为终点;
④ 重复三次,消耗硫酸铈溶液平均体积为25.00mL。
已知:CuCl的分子式量为99;CuCl + FeCl3 = CuCl2 + FeCl2; Fe2+ + Ce4+ = Fe3+ + Ce3+。
则CuCl的纯度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓H2SO4(密度为1.84g/cm3)配制1 mol/L的稀H2SO4 90 mL,配制过程中需用仪器的先后顺序是( )
①20 mL量筒 ②10 mL量筒 ③50 mL烧杯 ④托盘天平 ⑤100 mL容量瓶 ⑥胶头滴管 ⑦玻璃棒
A.①③⑤⑥⑦ B.②③⑦⑤⑥
C.②⑤⑦⑥① D.④③⑦⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.医用酒精是质量分数为95%的乙醇溶液
B.用过滤的方法可以分离乙酸乙酯和乙酸
C.葡萄糖、氨基酸在一定条件下都能发生酯化反应
D.往蛋白质溶液中加入浓的CuSO4溶液,蛋白质会发生盐析
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s) + 2NO(g) ![]() N2(g) + CO2(g) ΔH,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g) + CO2(g) ΔH,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.96 | 0.96 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.72 | 0.72 |
CO2 | 0 | 0.42 | 0.60 | 0.60 | 0.72 | 0.72 |
①根据图表数据分析T1℃时,该反应在0-20min的平均反应速率
v(N2)= mol·L-1·min-1;计算该反应的平衡常数K= 。
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是 (填字母代号)。
A.加入合适的催化剂
B.适当缩小容器的体积
C.通入一定量的NO
D.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则达到新平衡时NO的转化率 (填“升高”或“降低”),ΔH 0(填“>”或“<”).
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式 。
(3)二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中可以大量共存的是( )
A.Mg2+、Fe3+、Cl-、OH-
B.Ba2+、HCO3-、Cl-、Na+
C.Fe2+、SO42-、H+、NO3-
D.K+、NH4+、SO42-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某化学反应过程中能量变化的曲线图。下列有关叙述正确的是( )
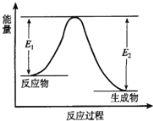
A.该反应为吸热反应
B.该图可以表示Ba(OH)2.8H2O与NH4Cl的反应
C.化学反应中的能量变化只表现为热量的变化
D.化学反应中有旧键断裂就一定有新键形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于加成反应的是( )
A.乙烯使溴的四氯化碳溶液褪色
B.乙烯使酸性KMnO4溶液褪色
C.将苯滴入溴水中,振荡后水层接近无色
D.甲烷与氯气混合,光照后黄绿色变浅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com