
【题目】I.有下列8种有机物按要求作答:
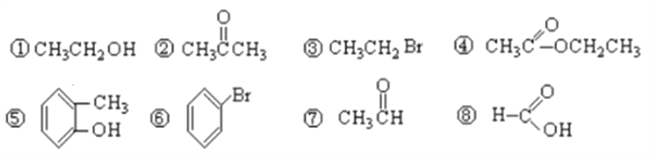
(1)按官能团分类,其中属于羧酸的有___________(填序号),属于醇的有_________(填序号);
(2)④中所含官能团的名称_______________,⑦中所含官能团结构简式_____________;
II.下列各组中的两种有机物,可能是:A.同一物质 B.同系物 C.同分异构体,请判断它们之间的关系(用字母完成填空):
(3)2-甲基丁烷和丁烷_______________;
(4)正戊烷和新戊烷_________________;
(5)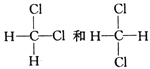 ______________。
______________。
【答案】 ⑧ ① 酯基 —CHO B C A
【解析】试题分析:本题考查有机物中官能团的识别,有机物的分类,同系物和同分异构体的判断。
I.①CH3CH2OH中官能团为羟基,属于醇;②![]() 中官能团为羰基,属于酮;③CH3CH2Br中官能团为溴原子,属于卤代烃;④CH3COOCH2CH3中官能团为酯基,属于酯;⑤
中官能团为羰基,属于酮;③CH3CH2Br中官能团为溴原子,属于卤代烃;④CH3COOCH2CH3中官能团为酯基,属于酯;⑤![]() 中官能团为羟基,羟基与苯环碳直接相连,属于酚;⑥
中官能团为羟基,羟基与苯环碳直接相连,属于酚;⑥![]() 中官能团为溴原子,属于卤代烃;⑦
中官能团为溴原子,属于卤代烃;⑦![]() 中官能团为醛基,属于醛;⑧HCOOH中官能团为羧基,属于羧酸。
中官能团为醛基,属于醛;⑧HCOOH中官能团为羧基,属于羧酸。
(1)按官能团分类,属于羧酸的有⑧,属于醇的有①。
(2)④中官能团的名称为酯基,⑦中官能团为醛基,醛基的结构简式为—CHO。
II.(3)2-甲基丁烷的结构简式为(CH3)2CHCH2CH3,分子式为C5H12;丁烷的结构简式为CH3CH2CH2CH3,分子式为C4H10;两者结构相似,分子组成上相差一个“CH2”,2-甲基丁烷和丁烷互为同系物,答案选B。
(4)正戊烷的结构简式为CH3CH2CH2CH2CH3,分子式为C5H12;新戊烷的结构简式为C(CH3)4,分子式为C5H12;两者分子式相同,结构不同,正戊烷和新戊烷互为同分异构体,答案选C。
(5)二氯甲烷的空间构型为四面体型,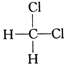 和
和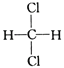 都表示二氯甲烷,为同一物质,答案选A。
都表示二氯甲烷,为同一物质,答案选A。


科目:高中化学 来源: 题型:
【题目】浓硫酸是常用的干燥剂,根据需要可将浓硫酸配成不同浓度的稀硫酸。回答下列问题:
(1)![]()
![]() 的
的![]() 溶液中含有
溶液中含有![]() ______g,含有
______g,含有![]() ______个,将此溶液与足 量的铝片反应,生成的气体在标准状况下体积为______L。
______个,将此溶液与足 量的铝片反应,生成的气体在标准状况下体积为______L。
(2)配制上述稀硫酸需要量取质量分数为![]() ,密度为
,密度为![]() 的浓硫酸_____mL
的浓硫酸_____mL![]() 结果保留一位小数
结果保留一位小数![]() 。配制此溶液需要的玻璃仪器除了烧杯、玻璃棒、胶头滴管外还需要______________________________。
。配制此溶液需要的玻璃仪器除了烧杯、玻璃棒、胶头滴管外还需要______________________________。
(3)稀释浓硫酸的操作是_________________________________________________。
(4)下列操作使配制的硫酸溶液的物质的量浓度偏小的是______。
A.稀释浓硫酸时有液体溅出
B.容量瓶中有少量蒸馏水残留
C.浓硫酸稀释后溶液没有冷却到室温就转移
D.向容量瓶加水定容时仰视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析正确的是( )
A. CuS的溶解度大于PbS的溶解度
B. 原生铜的硫化物具有还原性,而铜蓝没有还原性
C. CuSO4与ZnS反应的离子方程式是Cu2++S2-===CuS↓
D. 整个过程涉及的反应类型有氧化还原反应和复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】120 mL含有0.20 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
A. 2.0 mol·L-1 B. 1.5 mol·L-1 C. 0.18 mol·L-1 D. 0.24 mol·L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究过氧化钠的强氧化性,某研究性学习小组设计了如图所示的实验装置。
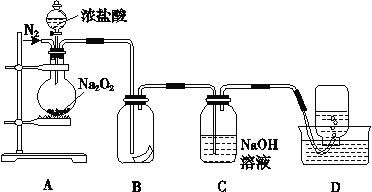
实验步骤及现象如下:
①检查装置气密性后,装入药品Na2O2并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸
入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,剧烈反应,产生黄绿色气体。
③一段时间后,将导管末端伸入集气瓶中收集气体。装置D中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色。
回答下列问题:
(1)装置B中湿润的红色纸条褪色,证明A中反应有______(填化学式)生成。若将B中红纸条改为湿润的紫石蕊试纸,现象为 _______
(2)实验前通N2的目的 ____,装置C的作用是_______
(3)甲同学认为O2是Na2O2被盐酸中的HCl还原所得。乙同学认为此结论不正确,其不赞成的理由可能为: ①_______;②O2有可能是Na2O2与盐酸中的H2O反应所得.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求答题
I.NaNO2 因外观和食盐相似,又有咸味,容易使人误食中毒。已知 NaNO2能发生反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是 ________。
(2)根据上述反应,鉴别 NaNO2 和 NaCl。可选用的物质有①水、②碘化钾淀粉试纸③淀粉、④白酒、⑤食醋,你认为必须选用的物质有________(填序号)。
(3)请配平以下化学方程式:____Al+____NaNO3+____ NaOH= ____NaAlO2+____ N2↑+___H2O,________________,若反应过程中转移 5 mol 电子,则生成标准状况下 N2 的体积为_________L。
II.向100mL1.5mol/L的氢氧化钠溶液中缓慢通入一定量的CO2,反应后,向所得溶液中逐滴缓慢滴加一定浓度的盐酸,所得气体的体积与所加盐酸的体积(不考虑气体溶解于水)关系如图所示。
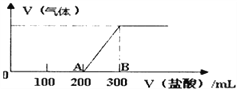
则:①氢氧化钠溶液与一定量的CO2充分反应后的溶液中溶质为____(写化学式)。
②盐酸的浓度为_______。
③B点时,产生的气体在标准状况下的体积为_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性KMnO4、H2O2在生活、卫生医疗中常用作消毒剂,其中H2O2还可用于漂白,是化学实验室里必备的重要氧化试剂。高锰酸钾造成的污渍可用还原性的草酸(H2C2O4)去除,Fe(NO3)3也是重要的氧化试剂,下面是对这三种氧化剂性质的探究。
(1)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,写出该反应的离子方程式____________________,氧化产物与还原产物的物质的量之比为_______。
(2)取300 mL 0.2 mol·L-1的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则转移电子的物质的量是_____ mol。
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的原因是_________________(用文字表达),又变为棕黄色的离子方程式是_____________________。
(4)测定KMnO4样品的纯度可用标准Na2S2O3溶液进行滴定,取0.474 g KMnO4样品溶解酸化后,用0.100 mol·L-1标准Na2S2O3溶液进行滴定,标准Na2S2O3溶液应盛装在___(填“酸式”或“碱式”)滴定管中。配平上述反应的离子方程式:___MnO4-+___S2O32-+____H+=____Mn2++_____SO42-+____H2O,实验中,滴定至终点时消耗Na2S2O3溶液12.00 mL,则该样品中KMnO4的物质的量是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,加热等物质的量的NaHCO3和Na2O2的固体混合物,充分反应后,容器中固体剩余物是( )
A. Na2CO3和Na2O2 B. Na2CO3和NaOH
C. NaOH和Na2O2 D. NaOH、Na2O2和Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com