
【题目】双氧水(![]() )是一种极弱电解质,也是一种“绿色氧化剂”。为了贮存、运输的方便,工业上将其转化为固态过碳酸钠(
)是一种极弱电解质,也是一种“绿色氧化剂”。为了贮存、运输的方便,工业上将其转化为固态过碳酸钠(![]() ),该物质具有
),该物质具有![]() 与
与![]() 的双重性质。q请回答下列问题:
的双重性质。q请回答下列问题:
(1)写出![]() 的电子式:____________,并写出它与
的电子式:____________,并写出它与![]() 反应的化学方程式___________________________。
反应的化学方程式___________________________。
(2)若把![]() 看成二元弱酸,写出它在水中第一步电离的方程式__________。
看成二元弱酸,写出它在水中第一步电离的方程式__________。
(3)下列物质不会使过碳酸钠失效的是__________________。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(4)稀![]() 不与Cu反应,但在稀
不与Cu反应,但在稀![]() 中加入
中加入![]() 后则可使Cu溶解,写出该反应的化学方程式,并用单线桥标明电子转移的方向和数目:_________________________。
后则可使Cu溶解,写出该反应的化学方程式,并用单线桥标明电子转移的方向和数目:_________________________。
【答案】![]() ; H2O2+SO2=H2SO4 H2O2
; H2O2+SO2=H2SO4 H2O2![]() H++HO2- B
H++HO2- B 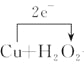 +H2SO4=CuSO4+2H2O
+H2SO4=CuSO4+2H2O
【解析】
(1)H2O2分子中有一个过氧键(—O—O—)和2个氢氧键(H—O),电子式为:![]() ,H2O2具有氧化性,SO2具有还原性,H2O2与SO2反应生成H2SO4,反应的化学方程式为H2O2+SO2=H2SO4,故答案为:
,H2O2具有氧化性,SO2具有还原性,H2O2与SO2反应生成H2SO4,反应的化学方程式为H2O2+SO2=H2SO4,故答案为:![]() ;H2O2+SO2=H2SO4;
;H2O2+SO2=H2SO4;
(2)双氧水可以可作是二元弱酸,说明双氧水分子能发生两步电离,其电离方程式为H2O2![]() H++HO2-、HO2-
H++HO2-、HO2-![]() H++O22-,故答案为:H2O2
H++O22-,故答案为:H2O2![]() H++HO2-、HO2-
H++HO2-、HO2-![]() H++O22-;
H++O22-;
(3)A、过氧化氢在二氧化锰的催化之下发生分解反应,所以会导致过碳酸钠晶体变质,故A错误;
B、NaHC03既不与过氧化氢(H2O2)反应也不与碳酸钠反应而变质,故B正确;
C、H2O2能氧化硫化氢生成单质硫,所以会导致过碳酸钠晶体变质,故C错误;
D、CH3COOH能与碳酸钠反应生成二氧化碳,所以会导致过碳酸钠晶体变质,故D错误;
故选B,故答案为:B;
(4)双氧水具有氧化性,在酸性环境下能将金属铜氧化,方程式为:Cu+H2O2+2HCl=
CuCl2+2H2O,1molCu参与反应,转移电子数目为2mol,用单线桥标明电子转移的方向和数目如下: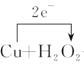 +H2SO4=CuSO4+2H2O,故答案为:
+H2SO4=CuSO4+2H2O,故答案为: +H2SO4=CuSO4+2H2O。
+H2SO4=CuSO4+2H2O。


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】工业上用铋酸钠(NaBiNO3)检验溶液中的Mn2+,反应方程式为:4MnSO4+10NaBiO3+14H2SO4═4NaMnO4+5Bi2(SO4)3+3Na2SO4+口,下列说法不正确的是
A. 口内的物质为水,配平系数为14。
B. 若生成1mol NaMnO4,则转移5mole-
C. 反应方程式中的硫酸可换为盐酸
D. 溶液中有Mn2+的现象是溶液变为紫红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为测定Na2CO3固体(含少量NaCl)的纯度,设计如下装置(含试剂)进行实验。
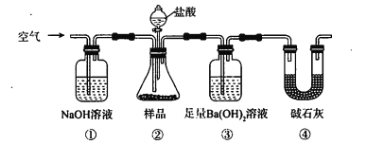
下列说法不正确的是
A. 必须在②③间添加吸收HCl的装置
B. ④的作用是防止空气中的气体影响实验的精确度
C. 通入空气的作用是保证②中产生的气体完全转移到③中
D. 称取样品和③中产生的沉淀的质量即可求算Na2CO3固体的纯度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)Ⅰ.某探究性学习小组用相同质量的锌和相同浓度的足量的稀硫酸反应得到实验数据如下表所示:
实验编号 | 锌的状态 | 反应温度/℃ | 收集100 mL氢气所需时间/s |
1 | 块状薄片 | 15 | 200 |
2 | 块状薄片 | 25 | 90 |
3 | 粉末 | 25 | 10 |
(1)该实验的目的是探究________、________对锌和稀硫酸反应速率的影响;
(2)实验1和2表明___________________________,化学反应速率越大;
(3)能表明固体的表面积对反应速率有影响的实验编号是________和_____________;
(4)请设计一个实验方案证明硫酸的浓度对该反应的速率的影响:_________________________。
Ⅱ.近年来,随着人们大量的开发使用,不但使得煤、石油、天然气的储量大大减少,而且直接燃烧化石燃料造成的环境污染问题,也是人类面临的重大挑战,如何实现化石燃料的综合利用,提高效率,减少污染提上了日程.
为了提高煤的利用率,人们先把煤转化为CO和H2,再将它们转化为甲醇,某实验人员在一定温度下的密闭容器中,充入一定量的H2和CO,发生反应:2H2(g)+CO(g) ![]() CH3OH(g),测定的部分实验数据如下:
CH3OH(g),测定的部分实验数据如下:
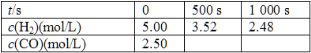
(1)在500 s内用H2表示的化学反应速率是__________________ mol/(L·S)。
(2)在1 000 s内用CO表示的化学反应速率是________ mol/(L·S), 1 000 s时CO的转化率是__________。
(3)在500 s时生成的甲醇的浓度是________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质Ⅲ(2,3-二氢苯并呋喃)是一种重要的精细化工原料,其合成的部分流程如下:
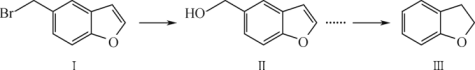
下列叙述正确的是
A. 物质Ⅲ的核磁共振氢谱图显示有四种不同环境的氢
B. 物质Ⅰ在NaOH醇溶液中加热可发生消去反应
C. 物质Ⅱ中所有原子可能位于同一平面内
D. 物质Ⅲ与足量H2加成所得产物分子中有2个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微型纽扣电池在现代生活中有广泛应用。有一种银锌电池,其电极材料分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应式为Zn+2OH2e===Zn(OH)2,Ag2O+H2O+2e===2Ag+2OH。下列叙述中正确的是( )

A. 在使用过程中,电解质KOH不断被消耗
B. 使用过程中,电子由Ag2O极经外电路流向Zn极
C. Zn电极发生还原反应,Ag2O电极发生氧化反应
D. Zn是负极,Ag2O是正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: ①CO(g)+1/2O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1 ②H2(g)+1/2O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1下列说法正确的是( )
A. 常温常压时,燃烧1mol氢气放热为241.8 kJ
B. 由①可知,1 mol CO(g)和1/2mol O2(g)反应生成 1 mol CO2(g),放出283.0 kJ的热量
C. 可用下图表示CO2(g)→CO(g)+![]() O2(g)反应是吸热反应
O2(g)反应是吸热反应

D. 生成1 mol H2O(g),其反应热为-241.8 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构,下列关于X、Y、Z、W四种元素的描述,不正确的是( )
A. 原子半径:X>Y>Z>WB. 原子序数:Y>X>Z>W
C. 原子最外层电子数:Z>W>Y>XD. 金属性:X>Y,还原性:W2->Z-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明溶液中,能大量共存的离子组是( )
A.Cu2+、Na+、SO42-、Cl﹣B.Ba2+、Na+、OH﹣、SO42-
C.OH﹣、HCO3﹣、Ca2+、Na+D.K+、Na+、OH﹣、NO3﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com