
����Ŀ�������ģ���.ij̽����ѧϰС������ͬ������п����ͬŨ�ȵ�������ϡ���ᷴӦ�õ�ʵ���������±���ʾ��
ʵ���� | п��״̬ | ��Ӧ�¶�/�� | �ռ�100 mL��������ʱ��/s |
1 | ��״��Ƭ | 15 | 200 |
2 | ��״��Ƭ | 25 | 90 |
3 | ��ĩ | 25 | 10 |
��1����ʵ���Ŀ����̽��________��________��п��ϡ���ᷴӦ���ʵ�Ӱ�죻
��2��ʵ��1��2����___________________________����ѧ��Ӧ����Խ��
��3���ܱ�������ı�����Է�Ӧ������Ӱ���ʵ������________��_____________��
��4�������һ��ʵ�鷽��֤�������Ũ�ȶԸ÷�Ӧ�����ʵ�Ӱ�죺_________________________��
��.���������������Ǵ����Ŀ���ʹ�ã�����ʹ��ú��ʯ�͡���Ȼ���Ĵ��������٣�����ֱ��ȼ�ջ�ʯȼ����ɵĻ�����Ⱦ���⣬Ҳ���������ٵ��ش���ս�����ʵ�ֻ�ʯȼ�ϵ��ۺ����ã����Ч�ʣ�������Ⱦ�������ճ̣�
Ϊ�����ú�������ʣ������Ȱ�úת��ΪCO��H2���ٽ�����ת��Ϊ�״���ijʵ����Ա��һ���¶��µ��ܱ������У�����һ������H2��CO��������Ӧ��2H2(g)��CO(g) ![]() CH3OH(g)���ⶨ�IJ���ʵ���������£�
CH3OH(g)���ⶨ�IJ���ʵ���������£�
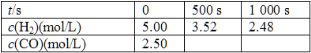
(1)��500 s����H2��ʾ�Ļ�ѧ��Ӧ������__________________ mol/��L��S����
(2)��1 000 s����CO��ʾ�Ļ�ѧ��Ӧ������________ mol/��L��S���� 1 000 sʱCO��ת������__________��
(3)��500 sʱ���ɵļ״���Ũ����________ mol/L��
���𰸡����������¶��¶�Խ��23����ͬ���¶��£�������ͬ״̬��������ͬ��пƬ�����������ͬ��Ũ�Ȳ�ͬ��ϡ���ᷴӦ2.96��10��3 mol/(L��s)1.26��10��3 mol/(L��s)50.4%0.74
��������
��. (1)��ʵ�����ݿ�֪��2��3�нӴ������ͬ��1��2���¶Ȳ�ͬ�����ʵ���Ŀ����̽�������������¶ȶ�п��ϡ���ᷴӦ���ʵ�Ӱ�졣(2)1��2�������¶ȸߵķ�Ӧʱ���٣�������¶�Խ�ߣ���Ӧ����Խ��(3) 2��3�нӴ������ͬ���Ӵ������ķ�Ӧʱ���٣����ܱ�������ı�����Է�Ӧ������Ӱ���ʵ����Ϊ2��3��ʵ��������������ز��䣬��������Խ��Ӧ����Խ�졣��4��֤��ϡ�����Ũ�ȶԸ÷�Ӧ�����ʵ�Ӱ�죬������ͬ��п�Ͳ�ͬŨ�ȵ�ϡ���ᷴӦ�������ʵ��Ϊ����ͬ���¶��£�������ͬ״̬�µ�������ͬ��пƬ�����������ͬ��Ũ�Ȳ�ͬ��ϡ���ᷴӦ����. (1)��500s����������ʾ�ķ�Ӧ����ΪV(H2)= 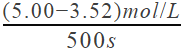 =2.96��10��3 mol/(L��s) (2)��1000s����������ʾ�Ļ�ѧ��Ӧ������V(H2)=
=2.96��10��3 mol/(L��s) (2)��1000s����������ʾ�Ļ�ѧ��Ӧ������V(H2)= 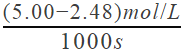 =2.52��10��3 mol/(L��s)����1000s����һ����̼��ʾ�ķ�Ӧ����Ϊ������һ�룬��Ϊ1.26��10��3 mol/(L��s)��1000sʱ����������Ũ��Ϊc(H2)=5.00-2.48=2.52mol/L��������ת����Ϊ2.52/5.00=50.4% �� (3)��500sʱ������Ũ�ȱ仯Ϊ5.00-3.52=1.48mol/L���ɷ�Ӧ����ʽ2H2(g)��CO(g)
=2.52��10��3 mol/(L��s)����1000s����һ����̼��ʾ�ķ�Ӧ����Ϊ������һ�룬��Ϊ1.26��10��3 mol/(L��s)��1000sʱ����������Ũ��Ϊc(H2)=5.00-2.48=2.52mol/L��������ת����Ϊ2.52/5.00=50.4% �� (3)��500sʱ������Ũ�ȱ仯Ϊ5.00-3.52=1.48mol/L���ɷ�Ӧ����ʽ2H2(g)��CO(g) ![]() CH3OH(g)��֪�����ɼ״������ʵ���Ũ��Ϊ 0.74mol/L��
CH3OH(g)��֪�����ɼ״������ʵ���Ũ��Ϊ 0.74mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ù����ռ���Һ����ij����(��Al2O3��MgO)�����˺�õ�����Һ�� NaHCO3��Һ�����������ҺpH��n[Al(OH)3]�����NaHCO3��Һ����仯����������ͼ��ʾ�������й�˵������ȷ����
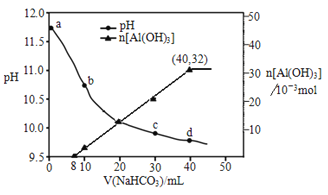
A. ���ɳ��������ӷ���ʽΪHCO3��+AlO2��+H2O��Al(OH)3��+CO32��
B. b ����c����Һ������������ͬ
C. a ����Һ�д������ڵ�������Na+��AlO2����OH��
D. NaHCO3��Һ�����ʵ���Ũ��Ϊ0.8mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������茶��壬��������Ҫ��ӦΪ4[NH4Al(SO4)2��12H2O] ![]() 2A12O3+2NH3��+N2��+5SO3��+3SO2��+53H2O��������������ͨ����ͼ��ʾ��װ��(�����Լ�������)������˵����ȷ����
2A12O3+2NH3��+N2��+5SO3��+3SO2��+53H2O��������������ͨ����ͼ��ʾ��װ��(�����Լ�������)������˵����ȷ����

A. ��Ӧ����Ԫ�ؼ����������������ֻ�ԭ��
B. װ�����п��Թ۲쵽���ְ�ɫ����������Ҫ�ɷ���BaSO4��BaSO3
C. װ�����п��Թ۲쵽���������ɫ��ȥ
D. ��װ��������˳�������ܹ۲쵽��ͬ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶�ʱ��N2��H2��Ӧ�����������仯����������ͼ��ʾ������������ȷ����( )
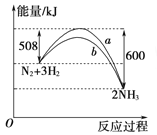
A. �÷�Ӧ���Ȼ�ѧ����ʽ��N2��3H2 = 2NH3��H����92 kJ/mol
B. b�����Ǽ������ʱ�������仯����
C. ����������û�ѧ��Ӧ�ų�����������
D. �����������������Ӧ���ʣ������淴Ӧ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(ClNO)����NO��Cl2��ͨ�������·�Ӧ���У���ѧ����ʽΪ2NO(g) + Cl2(g)![]() 2ClNO(g)��
2ClNO(g)��
��1����һ���¶���,�÷�Ӧ��һ�����ܱ������дﵽƽ��,����ͨ��Cl2���淴Ӧ����_____( �������١�����).
��2����֪���ֻ�ѧ���ļ����������±�( �������ȵĽṹΪCl-N=O)
��ѧ�� | N��O | ClһCl | ClһN | N=O |
����/kJ.mol-1 | 630 | 243 | a | 607 |
2NO(g)+Cl2(g)![]() 2ClNO(g) ��H=-111kJ/mol����a=_______��
2ClNO(g) ��H=-111kJ/mol����a=_______��
��3����1L�ĺ����ܱ������г���2molNO(g)��1mol Cl2(g)���ڲ�ͬ�¶��²��c(ClNO)��ʱ��Ĺ�ϵ��ͼA:
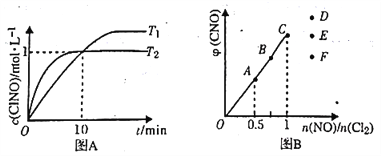
�ٸ÷�Ӧ�ġ�H_____0(�>����<����=��)��
�ڷ�Ӧ��ʼ��10min ʱNO ��ƽ����Ӧ����v( NO) =________mol/(L.min).
��T2ʱ�÷�Ӧ��ƽ�ⳣ��K=________��
��4��һ���������ں��º��ݵ��ܱ������а�һ����������NO(g)��Cl2(g)��ƽ��ʱClNO�����������n(NO)/n(Cl2)�ı仯ͼ����ͼB����A��B��C ��״̬�У�NO ��ת����������___�㣬��n(NO)/n(Cl2)=1.5ʱ���ﵽƽ��״̬ClNO ���������������D��E��F�����е�______�㡣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʾ���б仯�Ļ�ѧ���ﲻ��ȷ����( )
A. ��ˮ�Լ��ԣ�NH3��H2O![]() NH4++OH��
NH4++OH��
B. ������Һ�����ԣ�CH3COOH=CH3COO��+H+
C. NaHSO4��Һ�����ԣ�NaHSO4=Na++SO42��+H+
D. �����ڳ�ʪ�����б���ʴ�ĸ�����Ӧ��Fe��2e��=Fe2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��˫��ˮ��![]() ����һ�ּ�������ʣ�Ҳ��һ�֡���ɫ����������Ϊ�����桢����ķ��㣬��ҵ�Ͻ���ת��Ϊ��̬��̼���ƣ�
����һ�ּ�������ʣ�Ҳ��һ�֡���ɫ����������Ϊ�����桢����ķ��㣬��ҵ�Ͻ���ת��Ϊ��̬��̼���ƣ�![]() ��,�����ʾ���
��,�����ʾ���![]() ��
��![]() ��˫�����ʡ�q��ش��������⣺
��˫�����ʡ�q��ش��������⣺
��1��д��![]() �ĵ���ʽ��____________����д������
�ĵ���ʽ��____________����д������![]() ��Ӧ�Ļ�ѧ����ʽ___________________________��
��Ӧ�Ļ�ѧ����ʽ___________________________��
��2������![]() ���ɶ�Ԫ���ᣬд������ˮ�е�һ������ķ���ʽ__________��
���ɶ�Ԫ���ᣬд������ˮ�е�һ������ķ���ʽ__________��
��3���������ʲ���ʹ��̼����ʧЧ����__________________��
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
��4��ϡ![]() ����Cu��Ӧ������ϡ
����Cu��Ӧ������ϡ![]() �м���
�м���![]() �����ʹCu�ܽ⣬д���÷�Ӧ�Ļ�ѧ����ʽ�����õ����ű�������ת�Ƶķ������Ŀ��_________________________��
�����ʹCu�ܽ⣬д���÷�Ӧ�Ļ�ѧ����ʽ�����õ����ű�������ת�Ƶķ������Ŀ��_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ����С������Ǧ���ؽ��е�������ˮ��ʵ��̽������Ƶ�ʵ��װ����ͼ��ʾ������������ȷ���ǣ� ��

A. Y �ĵ缫��Ӧ�� Pb��2e�� = Pb2+
B. Ǧ���ع���ʱSO42-�� Y ���ƶ�
C. ���صķ�Ӧ����2Al+6H2O![]() 2Al(OH)3+3H2��
2Al(OH)3+3H2��
D. ÿ���� 103.5 gPb �������ϵ�����������0.5 molH2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ�У���ȷ���ǣ� ��
A.��Ͷ��ˮ�У�Na+H2O=Na++OH-+H2��
B.��ˮ����ϡ�����У�H++OH-=H2O
C.������Һ��������������Һ�У�Ba2++SO42-=BaSO4��
D.̼��������Һ����ϡ�����У�HCO3-+H+=CO2��+H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com