
【题目】微型纽扣电池在现代生活中有广泛应用。有一种银锌电池,其电极材料分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应式为Zn+2OH2e===Zn(OH)2,Ag2O+H2O+2e===2Ag+2OH。下列叙述中正确的是( )

A. 在使用过程中,电解质KOH不断被消耗
B. 使用过程中,电子由Ag2O极经外电路流向Zn极
C. Zn电极发生还原反应,Ag2O电极发生氧化反应
D. Zn是负极,Ag2O是正极
【答案】D
【解析】
银锌电池的电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH--2e-=ZnO+H2O;Ag2O+H2O+2e-=2Ag+2OH-,则Zn为负极,发生氧化反应,Ag2O为正极,发生还原反应,电子由负极流向正极,据此答题。
A.由两电极反应相加得电池总反应式:Zn+Ag2O=2Ag+ZnO,由总反应式可知,在使用过程中KOH不被消耗,故A错误;
B. Zn为负极,Ag2O为正极,则使用过程中,电子由Zn极经外电路流向Ag2O极,故B错误;
C. Zn电极发生氧化反应,Ag2O电极发生还原反应,故C错误;
D. Zn失去电子,Zn为负极,Ag2O得到电子是正极,故D正确。
故选D。


科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E和F的原子序数依次增大。元素A与元素C可形成A2C、A2C2两种化合物;元素C与元素D可形成D2C、D2C2两种化合物;元素B形成的化合物种类繁多且元素B与元素E处于同一主族;元素C与元素F处于同一主族。
(1)写出C的元素符号__________,D形成简单离子的结构示意图___________;
(2)写出元素A一种原子的中子数是质子数2倍的核素的符号____________;
(3)元素E在周期表中位置___________;
(4)比较E和F最高价氧化物对应水化物的酸性强弱______________(用化学式表示)
(5)写出A2C2电子式___________________;D与A形成化合物电子式_________________;元素A与B形成化合物A2B2的结构式________________;
(6)元素B与氮元素形成的化合物的晶体具有高熔点且耐磨等特点,推测该晶体是_________晶体。
(7)写出C与D以原子个数比1∶1形成的化合物与水反应的化学方程式:_________________;若生成0.5 mol氧化产物,则转移的电子数目为__________(用NA表示);
(8)取8.3g仅由D和氮元素形成的某化合物与足量水充分反应后产生0.1mol氨气,写出该化合物与过量盐酸反应的化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度时,N2与H2反应过程中能量变化的曲线如右图所示。下列叙述正确的是( )
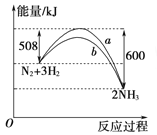
A. 该反应的热化学方程式:N2+3H2 = 2NH3ΔH=-92 kJ/mol
B. b曲线是加入催化剂时的能量变化曲线
C. 加入催化剂,该化学反应放出的热量增多
D. 加入催化剂可增大正反应速率,降低逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表示下列变化的化学用语不正确的是( )
A. 氨水显碱性:NH3·H2O![]() NH4++OH-
NH4++OH-
B. 醋酸溶液显酸性:CH3COOH=CH3COO-+H+
C. NaHSO4溶液显酸性:NaHSO4=Na++SO42-+H+
D. 钢铁在潮湿空气中被腐蚀的负极反应:Fe-2e-=Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双氧水(![]() )是一种极弱电解质,也是一种“绿色氧化剂”。为了贮存、运输的方便,工业上将其转化为固态过碳酸钠(
)是一种极弱电解质,也是一种“绿色氧化剂”。为了贮存、运输的方便,工业上将其转化为固态过碳酸钠(![]() ),该物质具有
),该物质具有![]() 与
与![]() 的双重性质。q请回答下列问题:
的双重性质。q请回答下列问题:
(1)写出![]() 的电子式:____________,并写出它与
的电子式:____________,并写出它与![]() 反应的化学方程式___________________________。
反应的化学方程式___________________________。
(2)若把![]() 看成二元弱酸,写出它在水中第一步电离的方程式__________。
看成二元弱酸,写出它在水中第一步电离的方程式__________。
(3)下列物质不会使过碳酸钠失效的是__________________。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(4)稀![]() 不与Cu反应,但在稀
不与Cu反应,但在稀![]() 中加入
中加入![]() 后则可使Cu溶解,写出该反应的化学方程式,并用单线桥标明电子转移的方向和数目:_________________________。
后则可使Cu溶解,写出该反应的化学方程式,并用单线桥标明电子转移的方向和数目:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别取等物质的量浓度的氢氧化钠溶液各![]() ,再通入一定量的
,再通入一定量的![]() ,随后分别各取
,随后分别各取![]() 溶液,向其中逐滴滴入
溶液,向其中逐滴滴入![]() 的盐酸,在标准状况下产生
的盐酸,在标准状况下产生![]() 的体积(y轴)与所加入盐酸的体积(x轴)的关系如图(分A、B两种情况):
的体积(y轴)与所加入盐酸的体积(x轴)的关系如图(分A、B两种情况):

(1)在A情况下,溶质是(填化学式)_____________________,其物质的量之比为______________
(2)在B情况下,溶质是(填化学式)____________________其物质的量之比为______________
(3)原氢氧化钠溶液的物质的量浓度 _____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组拟用铅蓄电池进行电絮凝净水的实验探究,设计的实验装置如图所示,下列叙述正确的是( )

A. Y 的电极反应: Pb-2e- = Pb2+
B. 铅蓄电池工作时SO42-向 Y 极移动
C. 电解池的反应仅有2Al+6H2O![]() 2Al(OH)3+3H2↑
2Al(OH)3+3H2↑
D. 每消耗 103.5 gPb ,理论上电解池阴极上有0.5 molH2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过如下实验由废铁屑制备FeSO4·7H2O晶体:
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2~3遍;
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80℃之间至铁屑耗尽;
③ ,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存.
请回答下列问题:
(1)实验步骤①的目的是___________________________________________。
(2)写出实验步骤②中的化学方程式__________________________________________。
(3)补全实验步骤③的操作名称_________________________。
(4)实验步骤④中用少量冰水洗涤晶体,其目的是_______________________________。
(5)乙同学认为甲的实验方案中存在明显的不合理之处,你______(填“是”或“否”)同意乙的观点
(6)丙同学经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4·7H2O、FeSO4·4H2O和FeSO4·H2O.硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示(仅在56.7℃、64℃温度下可同时析出两种晶体).
硫酸亚铁的溶解度和析出晶体的组成
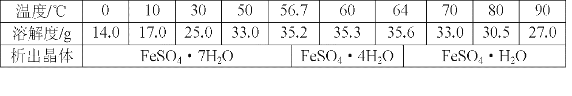
请根据表中数据画出硫酸亚铁的溶解度曲线示意图。__
(7)若需从硫酸亚铁溶液中结晶出FeSO4·4H2O,应控制的结晶温度(t)的范围为________________。
(8)取已有部分氧化的绿矾固体(硫酸亚铁的相对原子质量用M表示)wg,配制成100 mL用c mol/L KMnO4标准溶液滴定,终点时消耗标准液的体积为VmL,则:若在滴定终点读取滴定管读数时,俯视滴定管液面,使测定结果________(填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com