
【题目】分别取等物质的量浓度的氢氧化钠溶液各![]() ,再通入一定量的
,再通入一定量的![]() ,随后分别各取
,随后分别各取![]() 溶液,向其中逐滴滴入
溶液,向其中逐滴滴入![]() 的盐酸,在标准状况下产生
的盐酸,在标准状况下产生![]() 的体积(y轴)与所加入盐酸的体积(x轴)的关系如图(分A、B两种情况):
的体积(y轴)与所加入盐酸的体积(x轴)的关系如图(分A、B两种情况):

(1)在A情况下,溶质是(填化学式)_____________________,其物质的量之比为______________
(2)在B情况下,溶质是(填化学式)____________________其物质的量之比为______________
(3)原氢氧化钠溶液的物质的量浓度 _____________________
【答案】NaOH、Na2CO3 1∶1 Na2CO3、NaHCO3 1∶1 1.5 mol·L-1
【解析】
CO2与NaOH溶液反应有如下两种“边界”情况:CO2+2NaOH=Na2CO3+H2O…①,CO2+NaOH=NaHCO3…②,故反应后溶液中溶质的成分可有如下可能:Na2CO3和NaOH、Na2CO3、Na2CO3和NaHCO3、NaHCO3;当将稀盐酸逐滴滴到碳酸钠溶液中时,Na2CO3跟盐酸的反应是分步进行的:Na2CO3+HCl=NaHCO3+NaCl…③,NaHCO3+HCl=NaCl+H2O+CO2↑…④,并且可以看出,当反应完全进行时,两个过程消耗HCl的量相等,若溶液中还有氢氧化钠,则首先发生反应:NaOH+HCl=NaCl+H2O…⑤,根据反应的化学方程式结合消耗盐酸的体积进行计算。
(1)对于A图,V1=100mL,V2=150mL-100mL=50mL<V1,据此判断溶液中溶质的成分是Na2CO3和NaOH,根据上面⑤③④三个化学方程式可知,NaOH和Na2CO3的物质的量之比等于消耗盐酸的体积之比,则n(NaOH):n(Na2CO3)=(100mL-50mL):50mL=1:1,故答案为:Na2CO3和NaOH;1:1;
(2)对于B图,V1=50mL,V2=100mL.V1<V2.溶液中溶质的成分是Na2CO3和NaHCO3,根据上面③④两个反应的化学方程式可知:NaHCO3和Na2CO3的物质的量之比等于两个过程分别消耗盐酸的体积之比:n(NaHCO3):n(Na2CO3)=(150mL-50mL-50mL):50mL=1:1,故答案为:Na2CO3和NaHCO3;1:1;
(3)完全反应后,溶液溶质的成分为NaCl,根据质量守恒可知取出20mL溶液:n(NaOH)=n(HCl)=0.15L×0.2mol/L=0.03mol,所以100mLNaOH中溶液中n(NaOH)=0.15mol,
c(NaOH)= 0.15mol/0.1L=1.5mol/L,故答案为:1.5 mol/L。


科目:高中化学 来源: 题型:
【题目】NaCN是重要的化工原料,可应用于冶金等领域,回答下列问题:
(1)NaCN中C的化合价为_____;写出NaCN的电子式:_______________;
(2)现代开采金矿的流程如下:
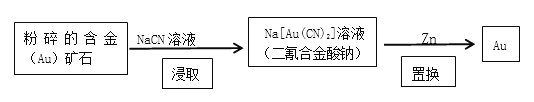
“粉碎”的目的是____________________;“浸取”反应的氧化剂是____________;消耗的锌与生成的金的物质的量之比为___________。
(3)工业上常用纯碱、焦炭、氨气反应制备NaCN,写出反应的化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔导电材料。下列说法一定正确的是( )

A. 该电池工作时,电子的流向外电路由A到B,内电路由B到A形成闭合回路
B. 电极B附近的HNO3浓度增大
C. A电极的反应为:NO2-e-+H2O==NO3-+2H+ NO-3e-+2H2O===NO3-+4H+
D. 该电池工作时,每消耗11.2LO2(标准状况下),可以除去含1molNO和NO2的混合尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产硫酸时,其中之一的反应是2SO2+O2![]() 2SO3,下列说法错误的是
2SO3,下列说法错误的是
A. 使用催化剂能显著增大反应速率
B. 压缩体积可提高反应速率
C. 达到化学平衡时,反应停止
D. 增大SO2的浓度可提高反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微型纽扣电池在现代生活中有广泛应用。有一种银锌电池,其电极材料分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应式为Zn+2OH2e===Zn(OH)2,Ag2O+H2O+2e===2Ag+2OH。下列叙述中正确的是( )

A. 在使用过程中,电解质KOH不断被消耗
B. 使用过程中,电子由Ag2O极经外电路流向Zn极
C. Zn电极发生还原反应,Ag2O电极发生氧化反应
D. Zn是负极,Ag2O是正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的选项正确的是
|
|
|
|
A.配制 0.10 mol·L-1NaOH溶液 | B.苯萃取碘水中I2,分出水层后的操作 | C.除去CO中的CO2 | D.记录滴定终点读数为12.20mL |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据有关信息完成下列各题:
(1)有机物A是人工合成的香料。其结构简式为: 。该化合物中含有的官能团名称是____。在一定条件下,1mol有机物A消耗H2和Br2的物质的量之比为:____。写出有机物A在催化剂作用下发生加聚反应的化学方程式:____。
。该化合物中含有的官能团名称是____。在一定条件下,1mol有机物A消耗H2和Br2的物质的量之比为:____。写出有机物A在催化剂作用下发生加聚反应的化学方程式:____。
(2)①用系统命名法命名 :____。②用习惯命名法命名
:____。②用习惯命名法命名 为:____。
为:____。
(3)实验室中通常加热无水乙醇与浓硫酸的混合物的方法制取乙烯,浓硫酸的作用是乙醇反应的催化剂和吸水剂。在具体的化学实验中常因加热的温度过低或过高导致副反应发生。如图所表示的装置可以用于确认乙烯气体中是否混有副反应生成的SO2。

可选择的化学试剂有:A.品红溶液 B.烧碱溶液 C.浓硫酸 D.酸性高锰酸钾溶液
回答下列问题:
(I)图中③的试管内盛放的化学试剂是____(填序号),其作用是____。
(II)根据④中消耗溶液的物质的量计算反应生成乙烯的物质的量,发现其数值远远小于理论生成的乙烯的物质的量,分析可能的原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电化学气敏传感器的工作原理如图所示,下列说法不正确的是

A. a极为负极
B. b极的电极反应式为O2+4e-+2H2O=4OH-
C. 电子流向:a经外电路流向b
D. 该传感器工作一段时间后,电解质溶液的pH值将变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指
A.蒸馏B.蒸发C.升华D.萃取
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com