
【题目】图所示装置中,甲、乙、丙三个烧杯依次分别盛放NaOH溶液、足量的CuSO4溶液和足量的 K2SO4溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加6.4g。以下说法不正确的是:
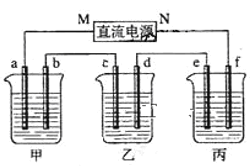
A.电源的N端为正极
B.电极b上发生的电极反应为4OH--4e-=2H2O+O2↑
C.b电极上生成气体1.12L,e电极上生成气体0.2 g
D.如果电解过程中铜全部析出,此时电解继续进行
【答案】C
【解析】
A、乙中c电极质量增加,则c处发生的反应为Cu2++2e-=Cu,即c处为阴极,由此可推出b为阳极,a为阴极,M为负极,N为正极,选项A正确;
B、甲中为NaOH溶液,相当于电解水,阳极b处为阴离子OH-放电,即4OH--4e-=2H2O+O2↑,选项B正确;
C、当乙中c电极质量增加6.4g时,根据Cu2++2e-=Cu可知转移0.2mol电子,电极b上发生的电极反应为4OH--4e-=2H2O+O2↑,则生成氧气0.05mol,标况下的体积为0.05mol×22.4L·mol-1=1.12L,但题中没说明标准状况,e电极上电极反应为2H++2e-=H2↑,生成气体0.1mol ![]() 2g/mol=0.2 g,选项C不正确;
2g/mol=0.2 g,选项C不正确;
D、如果电解过程中铜全部析出,则电解质溶液变为硫酸溶液,此时相当于电解水,电解继续进行,选项D正确。
答案选C。


科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭容器发生可逆反应:4NH3(g)+5O2(g) ![]() 4NO(g) +6H2O (g),下列说法能充分说明该反应已经达到化学平衡状态的是( )
4NO(g) +6H2O (g),下列说法能充分说明该反应已经达到化学平衡状态的是( )
A. 正逆反应速率相等且等于零
B. NH3、O2、NO和H2O浓度均相等
C. NH3、O2、NO和H2O在容器中共存
D. NH3、O2、NO和H2O浓度不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增加的X、Y、Z、W四种元素原子序数均小于36,Y基态原子最外层电子数是其内层电子总数的3倍,X、W基态原子是同周期元素中未成对电子数最多的原子,X与Z的原子核内质子数之和等于W原子核内质子数,Z基态原子只有1个未成对的电子。回答下列问题:
(1)已知化合物XZ3与H2Y(Y的氢化物)发生反应的化学方程式为XZ3+H2Y→XH3+HZY,则元素的电负性:Y______Z(填“大于”或“小于”),化合物HZY分子的空间构型为______。
(2)X的一种氢化物的相对分子质量为32,1mol该氢化物中的σ键数是______。
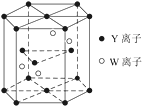
(3)①元素Y的一种单质分子与元素X、Y形成的一种离子互为等电子体,这两种微粒的化学式是_______、________。
②基态W原子的电子排布式是_______________。
(4)元素Y和W的一种化合物的晶体结构如图所示,该晶体的化学式为______;金属原子______(选填“钾”、“镁”、“铜”)形成的晶体的堆积方式,与上述晶胞中Y离子的堆积方式相同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示溶液中c(H+)和c(OH-)的关系,下列判断错误的是
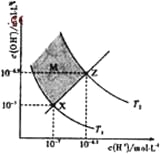
A. 两条曲线间任意点均有c(H+)×c(OH-)=Kw
B. M区域内任意点均有c(H+)<c(OH-)
C. 图中T1<T2
D. XZ线上任意点均有pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释工业生产或应用的化学方程式正确的是( )
A.氯碱工业制氯气:2NaCl(熔融)![]() 2Na+C12↑
2Na+C12↑
B.利用磁铁矿冶炼铁:CO+FeO![]() Fe+CO2
Fe+CO2
C.工业制小苏打:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl
D.工业制粗硅:C+SiO2![]() Si+CO2↑
Si+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,部分含铁元素的微粒在溶液中的物质的量分数与溶液pH的关系如图所示。下列说法错误的是( )

A.pH=4时,溶液中存在下列关系c(HFeO4-)>c(H2FeO4)>c(FeO42-)
B.H2FeO4的第一步电离平衡常数Ka1=4.15×10-4
C.B点溶液加NaOH溶液到pH为4的过程中,![]() 减小
减小
D.B、C两点对应溶液中水的电离程度:B<C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.0.1molNa2O2中阴离子的数目为0.2NA
B.1L0.1mol/L的HF溶液中F-数目为0.1NA
C.0.1molFe在点燃条件下与氧气反应时转移电子数目为0.3NA
D.0.4mol浓盐酸与足量的MnO2加热充分反应,产生Cl2的数目小于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饱和一元醇35.2g和足量的金属Na反应,生成标准状况下氢气为4.48L,该醇可氧化成醛,则其结构可能有几种( )
A.2种B.3种C.4种D.5种
查看答案和解析>>
科目:高中化学 来源: 题型:
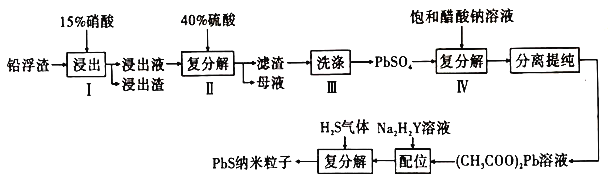
【题目】铅及其化合物用广泛,请回答下列相关问题:
(1)铅是碳的同族元素,比碳多4个电子层。铅元素的原子结构示意图为____________;相同温度下,同浓度的![]() 溶液和
溶液和![]() 溶液中水的电离程度___________(填“前者大”“后者大”或“一样大”)。
溶液中水的电离程度___________(填“前者大”“后者大”或“一样大”)。
(2)工业上利用锌冶炼过程中的铅浮渣(主要成分是![]() 、
、![]() ,含有少量
,含有少量![]() 、
、![]() 和其他不溶于硝酸的杂质)生产硫酸铅和硫化铅纳米粒子,流程如图所示:
和其他不溶于硝酸的杂质)生产硫酸铅和硫化铅纳米粒子,流程如图所示:
已知:a.25℃时,![]() ,
,![]() ,
,![]() 。
。
b.![]() 二钠简写成
二钠简写成![]() ,可以与
,可以与![]() 及其他许多金属离子形成稳定的配离子。
及其他许多金属离子形成稳定的配离子。
①已知步骤Ⅰ有![]() 产生,
产生,![]() 被足量稀硝酸氧化成
被足量稀硝酸氧化成![]() 。写出
。写出![]() 参加反应的离子方程式:________。
参加反应的离子方程式:________。
②步骤Ⅰ需控制硝酸的用量并使![]() 稍有剩余,原因是_________________________。
稍有剩余,原因是_________________________。
③硫酸铅微溶于水,醋酸铅易溶于水,步骤Ⅳ能发生反应的原因是____________________。
④不用硫化氢气体直接通入![]() 溶液来制备
溶液来制备![]() 纳米粒子的原因是__________________。
纳米粒子的原因是__________________。
⑤已知铅蓄电池工作时会产生![]() ,则铅蓄电池
,则铅蓄电池![]() 充电时的阳极反应式为________________________________。
充电时的阳极反应式为________________________________。
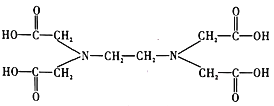
⑥![]() 又名乙二氨四乙酸,是一种弱酸(结构如图),在水溶液中可形成内盐(总电荷为0,电中性的化合物,但是带正电和负电的原子不同)。据此写出
又名乙二氨四乙酸,是一种弱酸(结构如图),在水溶液中可形成内盐(总电荷为0,电中性的化合物,但是带正电和负电的原子不同)。据此写出![]() 的结构:_________________。
的结构:_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com