
【题目】饱和一元醇35.2g和足量的金属Na反应,生成标准状况下氢气为4.48L,该醇可氧化成醛,则其结构可能有几种( )
A.2种B.3种C.4种D.5种
 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2:7% O2:11% N2:82%)。
| 0.1个大气压 | 0.5个大气压 | 1个大气压 | 10个大气压 |
400 | 99.2 | 99.6 | 99.7 | 99.9 |
500 | 93.5 | 96.9 | 97.8 | 99.3 |
600 | 73.7 | 85.8 | 89.5 | 96.4 |
(1)SO2的氧化反应是___反应(填“吸热”或“放热”)。
(2)根据图中所给信息,你认为工业上将SO2转化为SO3的适宜条件是___。
(3)选择适宜的催化剂,是否可以提高SO2的转化率?___(填“是”或“否”)。
(4)若保持温度和容积不变,平衡后通入氧气,再达平衡时则SO2浓度___。(填“增大”或“减小”)
(5)若保持温度和压强不变,平衡后通入He气,SO3的含量___。(填“增大”或“减小”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图所示装置中,甲、乙、丙三个烧杯依次分别盛放NaOH溶液、足量的CuSO4溶液和足量的 K2SO4溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加6.4g。以下说法不正确的是:
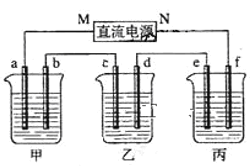
A.电源的N端为正极
B.电极b上发生的电极反应为4OH--4e-=2H2O+O2↑
C.b电极上生成气体1.12L,e电极上生成气体0.2 g
D.如果电解过程中铜全部析出,此时电解继续进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,CH3COOH与NH3H2O的电离常数均为1.8×10-5。现向20mL浓度为0.1mol/LNH3H2O的溶液中滴加等物质的量浓度的CH3COOH溶液,所得混合液的导电率与加入CH3COOH溶液的体积(V)的关系如图所示。
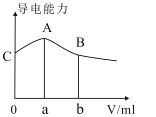
下列说法正确的是( )
A.a=20,A点溶液的pH=7
B.A、B两点中,B点溶液中水的电离程度最大
C.A点溶液中:c(CH3COO-)>c(NH4+)>c(H+)>c(OH-)
D.B、C两点中溶液的pH相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,根据图中数据,回答下列问题:
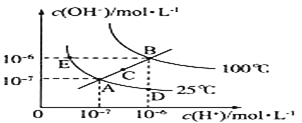
(1)图中A、B、C、D四点的Kw由大到小的顺序:________ 。
(2)若从A点到E点,可采用的方法是________。
(3)在100℃时,将pH=2的硫酸与pH=12的KOH溶液混合至呈中性,需硫酸和氢氧化钾的体积比为_____ 。
(4)pH=12的氢氧化钠溶液温度由25℃高到100℃,pH=________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn(s,白)+2HCl(aq)=SnCl2(aq)+H2(g) △H1
②Sn(s,灰)+2HCl(aq)=SnCl2(aq)+H2(g) △H2
③Sn(s,灰)![]() Sn(s,白) △H3=+2.1kJmol-1
Sn(s,白) △H3=+2.1kJmol-1
下列说法正确的是( )
A.△H1>△H2
B.锡在常温下以灰锡状态存在
C.灰锡转为白锡的反应是放热反应
D.锡制器皿长期处在低于13.2℃的环境中,会自行毁坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石经处理后得到明矾(KAl(SO4)2·12H2O)。由明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:
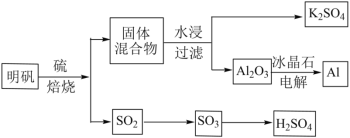
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,氧化剂和还原剂的物质的量之比为_______。
(2)从水浸后的滤液中得到K2SO4晶体的操作方法是_______。
(3)A12O3在一定条件下可制得AIN,AlN的晶体结构与金刚石相似,晶胞结构如图所示。每个晶胞中含有_______个铝原子,若Al与N原子最近距离为apm,则该晶体的密度为_______g/cm3。(阿伏加德罗常数用NA表示)
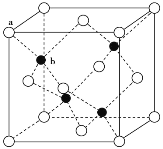
(4)SO2分子的空间构型为_______
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101kPa时
2SO2(g)+O2(g)![]() 2SO3(g)△H1=一197kJ/mol;
2SO3(g)△H1=一197kJ/mol;
2H2O(g)=2H2O(1)△H2=一44kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=一545kJ/mol。
则SO3(g)与H2O(l)反应的热化学方程式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1![]() 二元弱酸
二元弱酸![]() 溶液的pH,溶液中的
溶液的pH,溶液中的![]() 、
、![]() 、
、![]() 的物质的量分数
的物质的量分数![]() 随pH的变化如图所示[已知
随pH的变化如图所示[已知 ]。
]。

下列叙述错误的是( )
A. pH=1.2时, ![]()
B. ![]()
C. pH=2.7时, ![]()
D. pH=4.2时, ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如右图所示。下列有关说法错误的是( )

A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为:O2 + 2H2O + 4e == 4OH–
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为:2H+ + 2e == H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com