
【题目】工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2:7% O2:11% N2:82%)。
| 0.1个大气压 | 0.5个大气压 | 1个大气压 | 10个大气压 |
400 | 99.2 | 99.6 | 99.7 | 99.9 |
500 | 93.5 | 96.9 | 97.8 | 99.3 |
600 | 73.7 | 85.8 | 89.5 | 96.4 |
(1)SO2的氧化反应是___反应(填“吸热”或“放热”)。
(2)根据图中所给信息,你认为工业上将SO2转化为SO3的适宜条件是___。
(3)选择适宜的催化剂,是否可以提高SO2的转化率?___(填“是”或“否”)。
(4)若保持温度和容积不变,平衡后通入氧气,再达平衡时则SO2浓度___。(填“增大”或“减小”)
(5)若保持温度和压强不变,平衡后通入He气,SO3的含量___。(填“增大”或“减小”)
【答案】放热 1个大气压、400-500℃(或400℃) 否 减小 减小
【解析】
本题结合了硫酸的工业制取和化学平衡的相关知识,须注意工业流程除了要考虑转化率以外,成本和反应速率也是重要的考量因素,据此来逐项分析即可。
(1)绝大多数的化合反应都是放热的,绝大多数的分解反应都是吸热的,因此二氧化硫的氧化反应是放热的;
(2)先来看温度,400℃到500℃的转化率都比较高,适当提高温度虽然会牺牲一些转化率,但是可以显著提高反应速率;再来看压强,压强越大固然转化率越高,但是10个大气压对设备的要求较高,生产成本也会提升,产生的额外收益却不显著,因此选1个大气压即可;
(3)催化剂不改变平衡常数,因此不提高转化率;
(4)通入氧气相当于提高反应物的浓度,平衡会正向移动,因此二氧化硫的浓度减小;
(5)保持压强不变充入氦气,容器的体积增大,各气体的浓度降低,平衡要向气体分子数增大的方向移动,即逆向移动,因此三氧化硫的含量减小。


 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
【题目】25 ℃时,用0.1 mol·L-1 NaOH溶液滴定20 mL 0.1 mol·L-1 HX溶液,溶液的pH随加入的NaOH溶液体积的变化如图所示。下列说法不正确的是( )
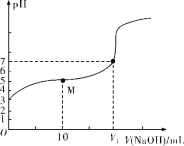
A.HX为弱酸
B.V1<20
C.M点溶液中离子浓度由大到小的顺序:c(X-)>c(Na+)>c(H+)>c(OH-)
D.0.1 mol·L-1 NaOH溶液和0.1 mol·L-1 HX溶液等体积混合后,溶液中c(Na+)=c(X-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭容器发生可逆反应:4NH3(g)+5O2(g) ![]() 4NO(g) +6H2O (g),下列说法能充分说明该反应已经达到化学平衡状态的是( )
4NO(g) +6H2O (g),下列说法能充分说明该反应已经达到化学平衡状态的是( )
A. 正逆反应速率相等且等于零
B. NH3、O2、NO和H2O浓度均相等
C. NH3、O2、NO和H2O在容器中共存
D. NH3、O2、NO和H2O浓度不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1molL-1的氨水滴定10.00 mL0.1molL-1的酸HA溶液,所加氨水的体积(V)与溶液中lg 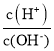 的关系如图所示。下列说法不正确的是
的关系如图所示。下列说法不正确的是
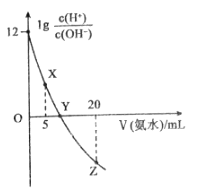
A.溶液中水的电离程度X<Y<Z
B.X点:c(A-)>c(H+)>c(NH4+)>c(OH-)
C.Y点:V(氨水)<10.00mL
D.Z点:2c(H+)+c(NH4+)=2c(OH-)+c(NH3H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2O(l)=2H2(g)+O2(g) ΔH=+571.0kJ/mol。以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如下:
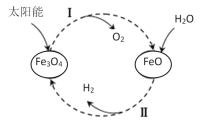
过程Ⅰ:2Fe3O4(s)=6FeO(s)+O2(g) ΔH=+313.2kJ/mol
过程Ⅱ:……
下列说法不正确的是( )
A.过程Ⅰ中每消耗232gFe3O4转移2mol电子
B.过程Ⅱ热化学方程式为:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH=-128.9kJ/mol
C.过程Ⅰ、Ⅱ中能量转化的形式依次是:太阳能→化学能→热能
D.铁氧化合物循环制H2具有成本低、产物易分离等优点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2g含有少量中性易溶杂质的样品,配成500mL待测溶液。称量时,样品可放在___(填字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.2000mol·L-1的盐酸来滴定待测溶液,不可选用__(填字母)作指示剂。
A.甲基橙 B.石蕊 C.酚酞
(3)滴定过程中,眼睛应注视___。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是__mol·L-1,烧碱样品的纯度是___(保留两位数字)。
滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
(5)下列实验操作会对滴定结果产生什么后果?(填“偏高”“偏低”或“无影响”)
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果___。
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增加的X、Y、Z、W四种元素原子序数均小于36,Y基态原子最外层电子数是其内层电子总数的3倍,X、W基态原子是同周期元素中未成对电子数最多的原子,X与Z的原子核内质子数之和等于W原子核内质子数,Z基态原子只有1个未成对的电子。回答下列问题:
(1)已知化合物XZ3与H2Y(Y的氢化物)发生反应的化学方程式为XZ3+H2Y→XH3+HZY,则元素的电负性:Y______Z(填“大于”或“小于”),化合物HZY分子的空间构型为______。
(2)X的一种氢化物的相对分子质量为32,1mol该氢化物中的σ键数是______。
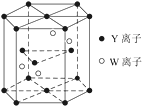
(3)①元素Y的一种单质分子与元素X、Y形成的一种离子互为等电子体,这两种微粒的化学式是_______、________。
②基态W原子的电子排布式是_______________。
(4)元素Y和W的一种化合物的晶体结构如图所示,该晶体的化学式为______;金属原子______(选填“钾”、“镁”、“铜”)形成的晶体的堆积方式,与上述晶胞中Y离子的堆积方式相同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示溶液中c(H+)和c(OH-)的关系,下列判断错误的是
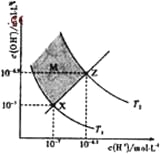
A. 两条曲线间任意点均有c(H+)×c(OH-)=Kw
B. M区域内任意点均有c(H+)<c(OH-)
C. 图中T1<T2
D. XZ线上任意点均有pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饱和一元醇35.2g和足量的金属Na反应,生成标准状况下氢气为4.48L,该醇可氧化成醛,则其结构可能有几种( )
A.2种B.3种C.4种D.5种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com