
【题目】水的电离平衡曲线如图所示,根据图中数据,回答下列问题:
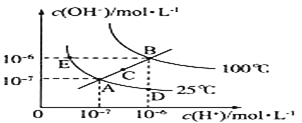
(1)图中A、B、C、D四点的Kw由大到小的顺序:________ 。
(2)若从A点到E点,可采用的方法是________。
(3)在100℃时,将pH=2的硫酸与pH=12的KOH溶液混合至呈中性,需硫酸和氢氧化钾的体积比为_____ 。
(4)pH=12的氢氧化钠溶液温度由25℃高到100℃,pH=________ 。
【答案】B>C>A=D 加入活泼金属钠、加氢氧化钠、氢氧化钡等 100:1 10
【解析】
(1)图A、E、D三点是同一曲线上,根据温度越高,离子积常数越大。
(2)若从A点到E点,温度相同,氢氧根浓度增加,氢离子浓度减小。
(3)在100℃时,先得出硫酸中c(H+)和KOH溶液中c(OH-),根据混合后呈中性得出硫酸和氢氧化钾的体积比。
(4) 25℃ pH=12的氢氧化钠溶液c(OH-),再得100℃时c(OH-),结合该温度下水的离子积计算氢离子浓度,再得pH。
(1)图A、E、D三点是同一曲线上,三点的离子积常数相等,温度是25℃,B点是100℃时的离子积常数,C温度在25℃和100℃之间,温度越高,离子积常数越大,因此A、B、C、D四点的Kw由大到小的顺序:B>C>A=D,故答案为:B>C>A=D。
(2)若从A点到E点,温度相同,氢氧根浓度增加,氢离子浓度减小,因此可采用的方法是加入活泼金属钠、加氢氧化钠、氢氧化钡等,故答案为:加入活泼金属钠、加氢氧化钠、氢氧化钡等。
(3)在100℃时,水的离子积为10-12,将pH=2的硫酸中c(H+)=0.01 molL﹣1,pH=12的KOH溶液中c(OH-)= 1 mol·L-1,两者混合至呈中性,![]() ,
,![]() ,需硫酸和氢氧化钾的体积比为100:1,故答案为:100:1。
,需硫酸和氢氧化钾的体积比为100:1,故答案为:100:1。
(4) 25℃ pH=12的氢氧化钠溶液c(OH-)=1×10﹣2 mol·L-1,100℃时c(OH-)=1×10﹣2 mol·L-1,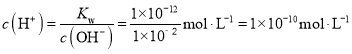 ,pH=10,故答案为:10。
,pH=10,故答案为:10。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】已知:2H2O(l)=2H2(g)+O2(g) ΔH=+571.0kJ/mol。以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如下:
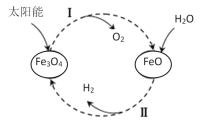
过程Ⅰ:2Fe3O4(s)=6FeO(s)+O2(g) ΔH=+313.2kJ/mol
过程Ⅱ:……
下列说法不正确的是( )
A.过程Ⅰ中每消耗232gFe3O4转移2mol电子
B.过程Ⅱ热化学方程式为:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH=-128.9kJ/mol
C.过程Ⅰ、Ⅱ中能量转化的形式依次是:太阳能→化学能→热能
D.铁氧化合物循环制H2具有成本低、产物易分离等优点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释工业生产或应用的化学方程式正确的是( )
A.氯碱工业制氯气:2NaCl(熔融)![]() 2Na+C12↑
2Na+C12↑
B.利用磁铁矿冶炼铁:CO+FeO![]() Fe+CO2
Fe+CO2
C.工业制小苏打:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl
D.工业制粗硅:C+SiO2![]() Si+CO2↑
Si+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.0.1molNa2O2中阴离子的数目为0.2NA
B.1L0.1mol/L的HF溶液中F-数目为0.1NA
C.0.1molFe在点燃条件下与氧气反应时转移电子数目为0.3NA
D.0.4mol浓盐酸与足量的MnO2加热充分反应,产生Cl2的数目小于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最新研制的人造纳米“竹子”可充分利用太阳能,并将其有效转化为氢能源。“竹子”的竹节和竹茎,分别由硫化镉和硫化锌两种不同的半导体材料组成。
(1)已知Cd与Zn位于同一副族,且在Zn的下一周期,则Cd的价电子排布图为___。已知Zn与Cu的能量变化如图所示,试解释步骤②吸收能量大于步骤④的原因___。
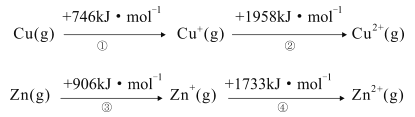
(2)CdS燃烧可生成CdO和SO2,SO2在空气中遇到微尘会缓慢转化为SO3。SO2中S的杂化方式为___,SO3分子的空间构型为___。
(3)O、S、Se为同主族元素,已知其对应氢化物的相关数据如下表:
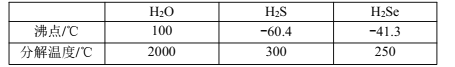
①H2Se沸点高于H2S的原因为___。
②H2O的分解温度高于H2S的原因为___。
(4)已知ZnS熔点为2830℃;CdS熔点为1750℃,则二者属于___晶体,ZnS熔点更高的原因为___。
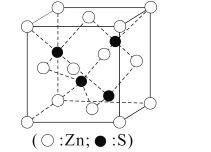
(5)如图为ZnS的晶胞图。若已知最近的锌离子之间距离为apm,则ZnS晶体的密度为___g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饱和一元醇35.2g和足量的金属Na反应,生成标准状况下氢气为4.48L,该醇可氧化成醛,则其结构可能有几种( )
A.2种B.3种C.4种D.5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列关于NaOH溶液和氨水的说法正确的是( )
A.25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为20:1
B.pH=13的两溶液稀释100倍,pH都为11
C.两溶液中分别加入少量NH4Cl固体,c(OH )均减小
D.体积相同、pH相同的两溶液能中和等物质的量的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是( )
A.除去Cl2中含有的少量HCl 
B.蒸干FeCl3饱和溶液制备FeCl3晶体
C.制取少量纯净的CO2气体
D.分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定体积的密闭容器中,加入2mol A和1mol B发生可逆反应2A(g)+B(g)3C(g)+D(g),达到平衡,C的浓度为w mol/L。若维持容器体积和温度不变,下列四种配比作为起始物质,达平衡后,C的浓度仍为w mol/L的是( )
A.4 mol A+2 mol B B.1 mol B+3 mol C+1 mol D
C.3 mol C+2 mol D D.1 mol A+0.5 mol B+1.5 mol C+0.5 mol D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com