
【题目】在一固定体积的密闭容器中,加入2mol A和1mol B发生可逆反应2A(g)+B(g)3C(g)+D(g),达到平衡,C的浓度为w mol/L。若维持容器体积和温度不变,下列四种配比作为起始物质,达平衡后,C的浓度仍为w mol/L的是( )
A.4 mol A+2 mol B B.1 mol B+3 mol C+1 mol D
C.3 mol C+2 mol D D.1 mol A+0.5 mol B+1.5 mol C+0.5 mol D
【答案】D
【解析】
2A(g)+B(g) ![]() 3C(g)+D(g)反应前后气体系数和改变,恒温、恒容条件下,两次投料的物质的量相同为等效平衡。
3C(g)+D(g)反应前后气体系数和改变,恒温、恒容条件下,两次投料的物质的量相同为等效平衡。
A.加入 4mol A、2mol B,投料为原来的2倍,相当于加压,平衡逆向移动,C的浓度大于w mol/L、小于2w mol/L,故不选A;
B. 加入1mol B、3mol C、1mol D,根据一边倒的原则,相当于加入了2mol A、4mol B,与原来的投料不同,C的浓度不是wmol/L,故不选B;
C.加入 3mol C、2mol D,根据一边倒的原则,相当于加入了2mol A、1mol B、1molD,相当于比原来多加1molD,平衡逆向移动,C的浓度小于w mol/L,故不选C;
D. 加入1mol A、0.5mol B、1.5mol C、0.5mol D,根据一边倒的原则,相当于加入了2mol A、1mol B,与原来的投料物质的量完全相同,为等效平衡,C的浓度仍为wmol/L,故选D。


科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,根据图中数据,回答下列问题:
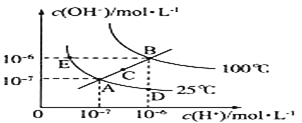
(1)图中A、B、C、D四点的Kw由大到小的顺序:________ 。
(2)若从A点到E点,可采用的方法是________。
(3)在100℃时,将pH=2的硫酸与pH=12的KOH溶液混合至呈中性,需硫酸和氢氧化钾的体积比为_____ 。
(4)pH=12的氢氧化钠溶液温度由25℃高到100℃,pH=________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如图:
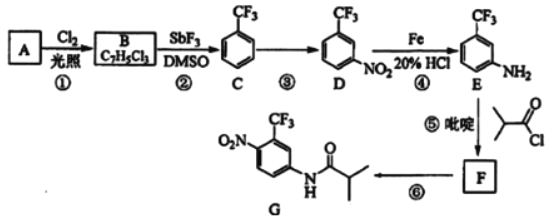
回答下列问题:
(1)A的结构简式为__。C的化学名称是__。
(2)③的反应试剂和反应条件分别是__,该反应的类型是__。
(3)⑤的反应方程式为__。吡啶是一种有机碱,其作用是__。
(4)G的分子式为__。
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有__种。
(6)4甲氧基乙酰苯胺(![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(![]() )制备4甲氧基乙酰苯胺的合成路线__(其他试剂任选)。
)制备4甲氧基乙酰苯胺的合成路线__(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L恒容绝热(不与外界交换能量)容器中进行2A(g) +B(g) =2C(g)+D(s)反应,按下表数据投料,反应10 s后达到平衡状态,测得体系压强升高,前10s内v(A)= 0.025 mol/(Ls)。下列说法正确的是

A. 达平衡时,2v正(A)=v逆(B) B. 平衡后,增加D的量,平衡逆向移动
C. 到达平衡时,n(B) =0.5 mol D. 温度升高,该反应的平衡常数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下:

下列说法错误的是( )
A.反应①阶段,参加反应的NaClO3和SO2的物质的量之比为2:1
B.若反应①通过原电池来实现,则ClO2是正极产物
C.反应②中的H2O2可用NaClO4代替
D.反应②条件下,ClO2的氧化性大于H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如右图所示。下列有关说法错误的是( )

A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为:O2 + 2H2O + 4e == 4OH–
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为:2H+ + 2e == H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用具有重要的社会意义。回答下列问题:
I.CO可用于高炉炼铁,已知:
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g) △H1=akJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H2=bkJ/mol
则反应Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)的△H=__kJ/mol。
Ⅱ.某温度下,在容积为2L的密闭容器中投入8molCO2(g)、16molH2(g)发生反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),15min后达到平衡,此时CO2的转化率为75%。则
CO(g)+H2O(g),15min后达到平衡,此时CO2的转化率为75%。则
①0~15min内用二氧化碳表示平均反应速率v(CO2)=__,
②计算此条件下该反应的平衡常数K=__。
Ⅲ.捕碳技术是指从空气中捕获二氧化碳的各种科学技术的统称。目前NH3和(NH4)2CO3等物质已经被用作工业捕碳剂。
(1)下列物质中能作为CO2捕获剂的是__。
A.Na2CO3 B.NaOH C.CH3CH2OH D.NH4Cl
(2)用(NH4)2CO3捕碳的反应:(NH4)2CO3(aq)+H2O(1)+CO2(g)![]() 2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充人一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充人一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
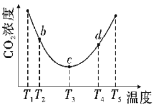
b、c、d三点的平衡常数Kb、Kc、Kd从大到小的顺序为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四甲基氢氧化铵[(CH3)4NOH]常用作电子工业清洗剂,以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法制备(CH3)4NOH,其工作原理如图所示,下列说法正确的是( )
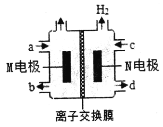
A.M电极的电极反应式为:4OH--4e-=O2↑+2H2O
B.N电极接电源的正极
C.阳离子通过离子交换膜往M电极移动
D.制备18.2g(CH3)4NOH,两极共产生4.48L气体(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用NaBr、浓H2SO4、乙醇为原料制备少量溴乙烷:
C2H5—OH+HBr![]() C2H5Br+H2O
C2H5Br+H2O
已知反应物的用量为:0.30 mol NaBr(s);0.25 mol C2H5OH(密度为0.80 g·cm-3);36 mL浓H2SO4(质量分数为98%,密度为1.84 g·mL-1);25 mL水。试回答下列问题。
(1)该实验应选择图中的a装置还是b装置?_____________。
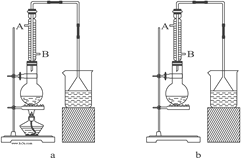
(2)反应装置中的烧瓶应选择下列哪种规格最合适(_____)
A.50 mL B.100 mL C.150 mL D.250 mL
(3)冷凝管中的冷凝水的流向应是(_____)
A. A进B出 B. B进A出 C. 从A进或B进均可
(4)可能发生的副反应为:_____________、__________、______________(至少写出3个方程式)。
(5)实验完成后,须将烧瓶内的有机物蒸出,结果得到棕黄色的粗溴乙烷,欲得纯净溴乙烷,应采用的措施是_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com