
【题目】研究和深度开发CO、CO2的应用具有重要的社会意义。回答下列问题:
I.CO可用于高炉炼铁,已知:
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g) △H1=akJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H2=bkJ/mol
则反应Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)的△H=__kJ/mol。
Ⅱ.某温度下,在容积为2L的密闭容器中投入8molCO2(g)、16molH2(g)发生反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),15min后达到平衡,此时CO2的转化率为75%。则
CO(g)+H2O(g),15min后达到平衡,此时CO2的转化率为75%。则
①0~15min内用二氧化碳表示平均反应速率v(CO2)=__,
②计算此条件下该反应的平衡常数K=__。
Ⅲ.捕碳技术是指从空气中捕获二氧化碳的各种科学技术的统称。目前NH3和(NH4)2CO3等物质已经被用作工业捕碳剂。
(1)下列物质中能作为CO2捕获剂的是__。
A.Na2CO3 B.NaOH C.CH3CH2OH D.NH4Cl
(2)用(NH4)2CO3捕碳的反应:(NH4)2CO3(aq)+H2O(1)+CO2(g)![]() 2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充人一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充人一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
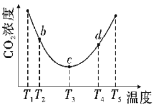
b、c、d三点的平衡常数Kb、Kc、Kd从大到小的顺序为__。
【答案】![]() 0.2mol/(L·min) 1.8 AB Kb>Kc>Kd
0.2mol/(L·min) 1.8 AB Kb>Kc>Kd
【解析】
I.CO可用于高炉炼铁,已知:①Fe3O4(s)+4CO(g)=3Fe(s)+4CO2 (g) △H1= a kJ/mol,②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H2=bkJ/mol,则1/3[①![]() +②]得反应;
+②]得反应;
II.设反应的CO2为Xmol,
CO2 (g)+H2(g) ![]() CO(g)+H2O(g)
CO(g)+H2O(g)
起始量(mol/L)4 8 0 0
变化量(mol/L)X X X X
平衡量(mol/L)4-X 8-X X X
由15min后达到平衡时CO2的转化率为75%,所以![]() =75%,所以X=3mol/L,再利用公式可求v(CO2),平衡常数K;
=75%,所以X=3mol/L,再利用公式可求v(CO2),平衡常数K;
III.(1)根据捕碳技术是指从空气中捕获二氧化碳的各种科学技术的统称。A.Na2CO3、B.NaOH均能和CO2反应,可以用作工业捕碳剂,而C.CH3CH2OH、D.NH4Cl均不能和CO2反应,故不可以用作工业捕碳剂;
(2)根据图像该化学反应随温度的升高,平衡逆向移动,所以该反应是放热反应,b、c、d三点温度逐渐升高,所以b、c、d三点的平衡常数K b >K c>Kd。
I.CO可用于高炉炼铁,已知:①Fe3O4(s)+4CO(g)=3Fe(s)+4CO2 (g) △H1= a kJ/mol,②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H2=bkJ/mol,则1/3[①![]() +②]得反应Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 (g)的△H=
+②]得反应Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 (g)的△H= ![]() kJ/mol,故答案为:
kJ/mol,故答案为:![]() ;
;
II.①设反应的CO2为Xmol,
CO2 (g)+H2(g) ![]() CO(g)+H2O(g)
CO(g)+H2O(g)
起始量(mol/L)4 8 0 0
变化量(mol/L)X X X X
平衡量(mol/L)4-X 8-X X X
由15min后达到平衡时CO2的转化率为75%,所以![]() =75%,所以X=3mol/L, 015 min CO2平均反应速率为v(CO2)= 3mol/L
=75%,所以X=3mol/L, 015 min CO2平均反应速率为v(CO2)= 3mol/L![]() 15min= 0.2mol/(L·min),故答案为:0.2mol/(L·min);
15min= 0.2mol/(L·min),故答案为:0.2mol/(L·min);
②上述条件下反应的平衡常数K=32![]() (1
(1![]() 5)=1.8,故答案为:1.8;
5)=1.8,故答案为:1.8;
III. (1) 根据捕碳技术是指从空气中捕获二氧化碳的各种科学技术的统称。A. Na2CO3、B. NaOH均能和CO2span>反应,可以用作工业捕碳剂,而C. CH3CH2OH、D. NH4Cl均不能和CO2反应,故可以用作工业捕碳剂。所以答案:AB;
(2)根据图像该化学反应随温度的升高,平衡逆向移动,所以该反应是放热反应,b、c、d三点温度逐渐升高,所以b、c、d三点的平衡常数K b >K c>Kd,所以答案:K b >K c>Kd。


科目:高中化学 来源: 题型:
【题目】常温下,下列关于NaOH溶液和氨水的说法正确的是( )
A.25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为20:1
B.pH=13的两溶液稀释100倍,pH都为11
C.两溶液中分别加入少量NH4Cl固体,c(OH )均减小
D.体积相同、pH相同的两溶液能中和等物质的量的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚石、石墨烯和![]() 都是碳的同素异形体,其结构示意图如图:
都是碳的同素异形体,其结构示意图如图:

(1)金刚石属立方晶系,每个晶胞所包括的C原子个数为_____________。
(2)金刚石、石墨烯、木炭和![]() 都是由碳元素组成的单质。下列关于碳的单质的叙述正确的是_______(填序号)。
都是由碳元素组成的单质。下列关于碳的单质的叙述正确的是_______(填序号)。
A.都是黑色固体
B.碳原子的排列方式不相同
C.这四种物质都很软,可作润滑剂
D.在氧气中充分燃烧时都生成二氧化碳
E.一定条件下,木炭转化成金刚石是物理变化
(3)金刚石质硬但脆,金刚石能被砸碎的原因是_______________________________。
(4)观察计算一个![]() 分子结构中含有____________个正五边形和_________个正六边形。
分子结构中含有____________个正五边形和_________个正六边形。
(5)石墨烯是单层的石墨,它是世界上已知的最薄、最坚硬的新型材料,有良好的导电性,具有很好的应用前景。石墨烯中碳原子的杂化轨道类型为___________;碳碳键的键角是___________。
(6)碳化硅(![]() )的结构与金刚石类似,设碳化硅的密度为
)的结构与金刚石类似,设碳化硅的密度为![]() ,碳化硅晶体内碳硅键的键长为________________
,碳化硅晶体内碳硅键的键长为________________![]() (用NA表示阿伏加德罗常数的值,列表达式即可)。
(用NA表示阿伏加德罗常数的值,列表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定体积的密闭容器中,加入2mol A和1mol B发生可逆反应2A(g)+B(g)3C(g)+D(g),达到平衡,C的浓度为w mol/L。若维持容器体积和温度不变,下列四种配比作为起始物质,达平衡后,C的浓度仍为w mol/L的是( )
A.4 mol A+2 mol B B.1 mol B+3 mol C+1 mol D
C.3 mol C+2 mol D D.1 mol A+0.5 mol B+1.5 mol C+0.5 mol D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
A.放电时负极反应为:Zn+2OH--2e-=Zn(OH)2
B.充电时阳极反应为:Fe(OH)3+5OH--3e-=FeO42-+4H2O
C.放电时每转移3mol电子,正极有1mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硝酸锶[Sr(NO3)2]可用于制造信号灯,光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如图:
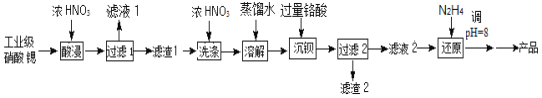
已知:①“滤渣1”的成份为Ba(NO3)2、Sr(NO3)2;②铬酸(H2CrO4)为二元弱酸
(1)用铬酸(H2CrO4)“沉钡”,是工业上常用的方法。H2CrO4中Cr元素的化合价为__,其在水中的电离方程式为___。
(2)“酸浸”不能采用高温的原因是__,“滤液1”的主要溶质是__(写化学式)。
(3)相对于水洗,用浓HNO3洗涤的优点是__。
(4)“滤液2”中过量的H2CrO4被N2H4还原为Cr3+,同时放出无污染的气体,写出发生反应的离子方程式__。
(5)已知Cr(OH)3类似氢氧化铝,还原后溶液的pH不能大于8的原因是(用离子方程式说明理由)__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属材料、无机非金属材料、有机高分子材料是人类使用的三大类基础材料,它们以各自的特点满足着人类多方面的需要。
(1)金属材料中,有一类贮氢合金能够结合氢气形成金属化合物,并在一定条件下分解释放出氢气,该贮运原理属于_______变化,钢铁是制造轮船的主要金属材料,船身外通常装上一定数目比铁更活泼的金属块以防止腐蚀,该金属块可以选择_______(选填“铜块”、“锌块”、“铅块”);
(2)无机非金属材料中,用于电子工业的高纯碳酸钙、高纯氧化钙生产流程如下:

请回答下列问题:
①硝酸钙与碳酸铵在溶液中反应,其基本反应类型为_______;
②实验室常采用_______操作进行沉淀分离;
③生产高纯碳酸钙时,选择“220℃恒温干燥”而不选择“灼烧”的原因是_______;
④高纯氧化钙生产过程中,“干燥”的主要目的是为了防止______(用化学方程式表示);
(3)有机高分子材料“玉米塑料”,因其可降解被广泛用来替代一次性泡沫塑料,“玉米塑料”的使用可减少_______污染,20世纪30年代,尼龙因其抽成细丝极像蚕丝而被推向世界,生活中可采用______方法区分尼龙和蚕丝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10mol·L-1的AgNO3溶液分别滴定体积均为50.0mL的由Cl-与Br-组成的混合溶液和由C1-与I-组成的混合溶液(两混合溶液中Cl-浓度相同,Br-与I-的浓度也相同),其滴定曲线如图所示。已知25℃时:Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=4.9×10-13,Ksp(AgI)=8.5×10-16。
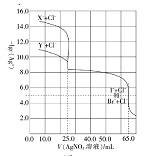
下列有关描述正确的是( )
A.图中X-为Br-
B.混合溶液中n(Cl-):n(I-)=8:5
C.滴定过程中首先沉淀的是AgCl
D.当滴入AgNO3溶液25mL时,Cl-与Br-组成的混合溶液中c(Ag+)=7×10-7mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油脂是重要的营养物质.某天然油脂A可发生下列反应:
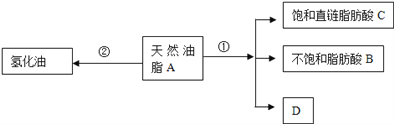
已知:A的分子式为C57H106O6.1mol该天然油脂A经反应①可得到1molD、1mol不饱和脂肪酸B和2mol直链饱和脂肪酸C.经测定B的相对分子质量为280,原子个数比为C:H:O=9:16:1;
(1)写出B的分子式:________________________;
(2)写出反应①的反应类型:____________;C的名称(或俗称)是_________;
(3)近日,电视媒体关于“氢化油危害堪比杀虫剂”的报道引发轩然大波,反应②为天然油脂的氢化过程.下列有关说法不正确的是_______________;
a.氢化油又称人造奶油,通常又叫硬化油.
b.植物油经过氢化处理后会产生副产品反式脂肪酸甘油酯,摄入过多的氢化油,容易堵塞血管而导致心脑血管疾病.
c.氢化油的制备原理是在加热植物油时,加入金属催化剂,通入氢气,使液态油脂变为半固态或固态油脂.
d.油脂的氢化与油脂的皂化都属于加成反应
(4)D和足量金属钠反应的化学方程式_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com