
【题目】高纯硝酸锶[Sr(NO3)2]可用于制造信号灯,光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如图:
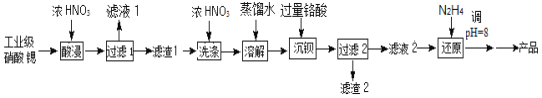
已知:①“滤渣1”的成份为Ba(NO3)2、Sr(NO3)2;②铬酸(H2CrO4)为二元弱酸
(1)用铬酸(H2CrO4)“沉钡”,是工业上常用的方法。H2CrO4中Cr元素的化合价为__,其在水中的电离方程式为___。
(2)“酸浸”不能采用高温的原因是__,“滤液1”的主要溶质是__(写化学式)。
(3)相对于水洗,用浓HNO3洗涤的优点是__。
(4)“滤液2”中过量的H2CrO4被N2H4还原为Cr3+,同时放出无污染的气体,写出发生反应的离子方程式__。
(5)已知Cr(OH)3类似氢氧化铝,还原后溶液的pH不能大于8的原因是(用离子方程式说明理由)__。
【答案】+6 H2CrO4![]() H++HCrO4-,HCrO4-
H++HCrO4-,HCrO4-![]() H++CrO42- 避免HNO3挥发和分解,减少环境污染 Ca(NO3)2 减少Sr(NO3)2溶解导致的损失 4H2CrO4+3N2H4+12H+=4Cr3++3N2↑+16H2O Cr(OH)3+OH=CrO2+2H2O
H++CrO42- 避免HNO3挥发和分解,减少环境污染 Ca(NO3)2 减少Sr(NO3)2溶解导致的损失 4H2CrO4+3N2H4+12H+=4Cr3++3N2↑+16H2O Cr(OH)3+OH=CrO2+2H2O
【解析】
取含杂质的硝酸锶样品,向其中加入浓HNO3溶解,搅拌,过滤,“滤液1”的主要溶质是Ca(NO3)2,“滤渣1”的成分为Ba(NO3)2、Sr(NO3)2,并用浓HNO3洗涤滤渣,减少Sr(NO3)2溶解,进一步洗掉附着的Ca(NO3)2,将滤渣1溶于水中,加过量铬酸使Ba2+沉淀,“滤渣2”的主要成分为BaCrO4,“滤液2”中过量的H2CrO4被N2H4还原为Cr3+,调节pH至7~8,Cr3+使转化为Cr(OH)3沉淀,过滤分离,将滤液经过蒸发浓缩、冷却结晶、过滤洗涤、干燥得产品,以此解答该题。
(1)H2CrO4中H元素为+1价,O元素为-2价,根据化合物中元素化合价代数和为零可知,Cr元素的化合价为+6价,因为H2CrO4为二元弱酸,其在水中的电离方程式为H2CrO4![]() H++HCrO4-,HCrO4-
H++HCrO4-,HCrO4-![]() H++CrO42-;故答案为:+6;H2CrO4
H++CrO42-;故答案为:+6;H2CrO4![]() H++HCrO4-,HCrO4-
H++HCrO4-,HCrO4-![]() H++CrO42-;
H++CrO42-;
(2)“酸浸”不能采用高温的原因是:避免HNO3挥发和分解,减少环境污染,由分析可知“滤液1”的主要溶质是Ca(NO3)2;故答案为:避免HNO3挥发和分解,减少环境污染;Ca(NO3)2;
(3)用浓HNO3洗涤可以减少Sr(NO3)2溶解导致的损失;故答案为:减少Sr(NO3)2溶解导致的损失;
(4)H2CrO4被N2H4还原为Cr3+,同时放出无污染的气体为氮气,反应离子方程式为:4H2CrO4+3N2H4+12H+=4Cr3++3N2↑+16H2O;故答案为:4H2CrO4+3N2H4+12H+=4Cr3++3N2↑+16H2O;
(5)已知Cr(OH)3类似Al(OH)3,还原后溶液的pH不能大于8,避免Cr(OH)3在碱性溶液中发生Cr(OH)3+OH=CrO2+2H2O而溶解;故答案为:Cr(OH)3+OH=CrO2+2H2O。


科目:高中化学 来源: 题型:
【题目】明矾石经处理后得到明矾(KAl(SO4)2·12H2O)。由明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:
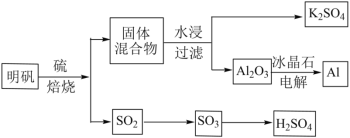
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,氧化剂和还原剂的物质的量之比为_______。
(2)从水浸后的滤液中得到K2SO4晶体的操作方法是_______。
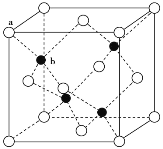
(3)A12O3在一定条件下可制得AIN,AlN的晶体结构与金刚石相似,晶胞结构如图所示。每个晶胞中含有_______个铝原子,若Al与N原子最近距离为apm,则该晶体的密度为_______g/cm3。(阿伏加德罗常数用NA表示)
(4)SO2分子的空间构型为_______
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101kPa时
2SO2(g)+O2(g)![]() 2SO3(g)△H1=一197kJ/mol;
2SO3(g)△H1=一197kJ/mol;
2H2O(g)=2H2O(1)△H2=一44kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=一545kJ/mol。
则SO3(g)与H2O(l)反应的热化学方程式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L恒容绝热(不与外界交换能量)容器中进行2A(g) +B(g) =2C(g)+D(s)反应,按下表数据投料,反应10 s后达到平衡状态,测得体系压强升高,前10s内v(A)= 0.025 mol/(Ls)。下列说法正确的是

A. 达平衡时,2v正(A)=v逆(B) B. 平衡后,增加D的量,平衡逆向移动
C. 到达平衡时,n(B) =0.5 mol D. 温度升高,该反应的平衡常数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如右图所示。下列有关说法错误的是( )

A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为:O2 + 2H2O + 4e == 4OH–
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为:2H+ + 2e == H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用具有重要的社会意义。回答下列问题:
I.CO可用于高炉炼铁,已知:
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g) △H1=akJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H2=bkJ/mol
则反应Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)的△H=__kJ/mol。
Ⅱ.某温度下,在容积为2L的密闭容器中投入8molCO2(g)、16molH2(g)发生反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),15min后达到平衡,此时CO2的转化率为75%。则
CO(g)+H2O(g),15min后达到平衡,此时CO2的转化率为75%。则
①0~15min内用二氧化碳表示平均反应速率v(CO2)=__,
②计算此条件下该反应的平衡常数K=__。
Ⅲ.捕碳技术是指从空气中捕获二氧化碳的各种科学技术的统称。目前NH3和(NH4)2CO3等物质已经被用作工业捕碳剂。
(1)下列物质中能作为CO2捕获剂的是__。
A.Na2CO3 B.NaOH C.CH3CH2OH D.NH4Cl
(2)用(NH4)2CO3捕碳的反应:(NH4)2CO3(aq)+H2O(1)+CO2(g)![]() 2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充人一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充人一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
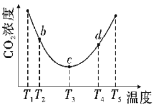
b、c、d三点的平衡常数Kb、Kc、Kd从大到小的顺序为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有 关汉黄芩素的叙述正确的是

A. 汉黄芩素的分子式为 C16H13O5
B. 该物质遇 FeCl3 溶液显色
C. 1 mol 该物质与溴水反应,最多消耗 1 mol Br2
D. 与足量 H2 发生加成反应后,该分子中官能团的种类减少 1 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四甲基氢氧化铵[(CH3)4NOH]常用作电子工业清洗剂,以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法制备(CH3)4NOH,其工作原理如图所示,下列说法正确的是( )
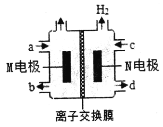
A.M电极的电极反应式为:4OH--4e-=O2↑+2H2O
B.N电极接电源的正极
C.阳离子通过离子交换膜往M电极移动
D.制备18.2g(CH3)4NOH,两极共产生4.48L气体(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国家航天局计划2020年实施火星探测任务。据了解火星上存在大量的含氮化合物,科学家推测火星生命可能主要以氮、碳、硅、铜为基体构成。
请回答下列问题:
(1)邻氨基吡啶(![]() )的铜配台物在有机不对称合成中起催化诱导效应。
)的铜配台物在有机不对称合成中起催化诱导效应。
①邻氨基吡啶中所有元素的电负性出小到大的顺序为__(填元素符号)。设NA为阿伏加德罗常数的值,1mol![]() 中含有σ键的数目为__。
中含有σ键的数目为__。
②一定条件下-NH2可以被氧化成-NO2,-NO2中N原子的杂化方式为__杂化。
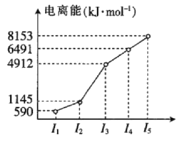
(2)第四周期的某主族元素,其第一至第五电离能数据如图所示,则该元素的基态原子电子排布式为___。
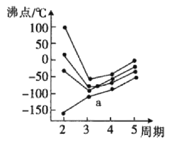
(3)元素周期表中的第IVA族~第VIIA族中部分元素的最简单氢化物的沸点变化趋势线如图,其中一个小黑点代表-种氢化物,则趋势线a代表第__族元素的最简单氢化物的沸点变化趋势,判断依据是__。
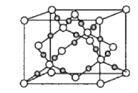
(4)干冰是常见的分子晶体,而CO2在高温高压下能形成另一种晶体其晶胞如图所示,该CO2晶体的熔点__(填“>”“<”或“=”)SiO2晶体的熔点。
(5)一种嘌呤和一种吡啶的结构如图。
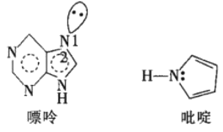
①嘌呤中轨道之间的夹角∠1比∠2大,原因是__。
②分子中的大π键可以用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则该吡啶中的大π键可表示为__。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则该吡啶中的大π键可表示为__。
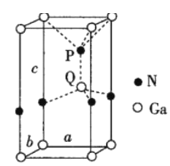
(6)火星岩石中存在大量的氮化镓,氮化镓为六方晶胞,结构如图所示。若该晶体密度为dg·cm-3,晶胞参数a=b≠c(单位:nm),a、b夹角为120°,阿伏加德罗常数的值为NA,则晶胞参数c=___nm(写出代数式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟及其化合物用途非常广泛。回答下列问题:
(1)基态锑(Sb)原子价电子排布的轨道式为____。[H2F]+[SbF6]—(氟酸锑)是一种超强酸,存在[H2F]+,该离子的空间构型为______,依次写出一种与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是_______、_________。
(2)硼酸(H3BO3)和四氟硼酸铵(NH4BF4)都有着重要的化工用途。
①H3BO3和NH4BF4涉及的四种元素中第二周期元素的第一电离能由大到小的顺序_____(填元素符号)。
②H3BO3本身不能电离出H+,在水中易结合一个OH﹣生成[B(OH)4]﹣,而体现弱酸性。[B(OH)4]﹣中B原子的杂化类型为_____。
③NH4BF4(四氟硼酸铵)可用作铝或铜焊接助熔剂、能腐蚀玻璃等。四氟硼酸铵中存在_______(填序号):
A 离子键 B σ键 C π键 D 配位键 E 范德华力
(3)某砷镍合金的晶胞如图所示,设阿伏加德罗常数的值为![]() ,该晶体的密度ρ_________g·cm-3。
,该晶体的密度ρ_________g·cm-3。
 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com