
【题目】明矾石经处理后得到明矾(KAl(SO4)2·12H2O)。由明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:
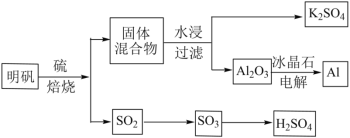
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,氧化剂和还原剂的物质的量之比为_______。
(2)从水浸后的滤液中得到K2SO4晶体的操作方法是_______。
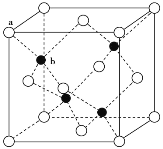
(3)A12O3在一定条件下可制得AIN,AlN的晶体结构与金刚石相似,晶胞结构如图所示。每个晶胞中含有_______个铝原子,若Al与N原子最近距离为apm,则该晶体的密度为_______g/cm3。(阿伏加德罗常数用NA表示)
(4)SO2分子的空间构型为_______
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101kPa时
2SO2(g)+O2(g)![]() 2SO3(g)△H1=一197kJ/mol;
2SO3(g)△H1=一197kJ/mol;
2H2O(g)=2H2O(1)△H2=一44kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=一545kJ/mol。
则SO3(g)与H2O(l)反应的热化学方程式是_______。
【答案】1:1 蒸发浓缩,冷却结晶 4 ![]() V形或角形 SO3(g)+H2O(l)=H2SO4(l)△H=-152kJ·mol-1
V形或角形 SO3(g)+H2O(l)=H2SO4(l)△H=-152kJ·mol-1
【解析】
(1)根据焙烧明矾方程式,判断出氧化剂和还原剂,即可知道答案;
(2)从溶液中得到固体硫酸钾,可以才用蒸发结晶的方法;
(3)AlN的晶胞中N原子数目为4,Al原子数目为8×![]() +6×
+6×![]() =4,顶点白色球与相邻黑色距离为晶胞体对角线的
=4,顶点白色球与相邻黑色距离为晶胞体对角线的![]() ,则晶胞体对角线长为4apm,晶胞棱长为
,则晶胞体对角线长为4apm,晶胞棱长为![]() pm,晶胞的体积为(
pm,晶胞的体积为(![]() pm)3,1mol晶胞的质量为4×41g,得其密度;
pm)3,1mol晶胞的质量为4×41g,得其密度;
(4) SO2分子中S原子价层电子对数=2+![]() =3,且含有1个孤电子对,根据价电子对互斥理论判断S原子的轨道杂化类型及分子的空间构型;
=3,且含有1个孤电子对,根据价电子对互斥理论判断S原子的轨道杂化类型及分子的空间构型;
(5) ①2SO2(g)+O2(g)2SO3(g)△H1=-197kJ/mol,②2H2O(g)=2H2O(1)△H2=-44kJ/mol,③2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=-545kJ/mol,依据盖斯定律③-①-②得到。
(1)4KAl(SO4)212H2O+3S═2K2SO4+2Al2O3+9SO2+48H2O反应硫单质中硫元素化合价升高为+4价。硫酸根离子中硫元素化合价从+6价变化为+4价,故还原剂是硫单质,而氧化剂是6mol的硫酸根离子,即3mol的4KAl(SO4)212H2O,氧化剂和还原剂的物质的量之比1:1,故答案为1:1;
(2)从溶液中得到固体硫酸钾,可以才用蒸发结晶的方法,故答案:蒸发浓缩,冷却结晶;
(3)AlN的晶胞中N原子数目为4,Al原子数目为8×![]() +6×
+6×![]() =4,顶点白色球与相邻黑色距离为晶胞体对角线的
=4,顶点白色球与相邻黑色距离为晶胞体对角线的![]() ,则晶胞体对角线长为4apm,晶胞棱长为
,则晶胞体对角线长为4apm,晶胞棱长为![]() pm,晶胞的体积为(
pm,晶胞的体积为(![]() pm)3,1mol晶胞的质量为4×41g,得其密度
pm)3,1mol晶胞的质量为4×41g,得其密度![]() g/cm3,故答案为:4;
g/cm3,故答案为:4;![]() ;
;
(4)SO2分子中S原子价层电子对数=2+![]() =3,且含有1个孤电子对,根据价电子对互斥理论判断S原子的轨道杂化类型为sp2,分子的空间构型为V形,故答案为:V形或角形;
=3,且含有1个孤电子对,根据价电子对互斥理论判断S原子的轨道杂化类型为sp2,分子的空间构型为V形,故答案为:V形或角形;
(5)①2SO2(g)+O2(g)2SO3(g)△H1=-197kJ/mol,②2H2O(g)=2H2O(1)△H2=-44kJ/mol,③2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=-545kJ/mol,依据盖斯定律③-①-②得到:2SO3(g)+2H2O(l)=2H2SO4(l)△H=-304 kJ/mol,即反应的热化学方程式为:SO3(g)+H2O(l)=H2SO4(l)△H=-152 kJ/mol;故答案为:SO3(g)+H2O(l)=H2SO4(l)△H=-152kJ/mol。


科目:高中化学 来源: 题型:
【题目】原子序数依次增加的X、Y、Z、W四种元素原子序数均小于36,Y基态原子最外层电子数是其内层电子总数的3倍,X、W基态原子是同周期元素中未成对电子数最多的原子,X与Z的原子核内质子数之和等于W原子核内质子数,Z基态原子只有1个未成对的电子。回答下列问题:
(1)已知化合物XZ3与H2Y(Y的氢化物)发生反应的化学方程式为XZ3+H2Y→XH3+HZY,则元素的电负性:Y______Z(填“大于”或“小于”),化合物HZY分子的空间构型为______。
(2)X的一种氢化物的相对分子质量为32,1mol该氢化物中的σ键数是______。
(3)①元素Y的一种单质分子与元素X、Y形成的一种离子互为等电子体,这两种微粒的化学式是_______、________。
②基态W原子的电子排布式是_______________。
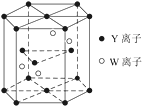
(4)元素Y和W的一种化合物的晶体结构如图所示,该晶体的化学式为______;金属原子______(选填“钾”、“镁”、“铜”)形成的晶体的堆积方式,与上述晶胞中Y离子的堆积方式相同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.0.1molNa2O2中阴离子的数目为0.2NA
B.1L0.1mol/L的HF溶液中F-数目为0.1NA
C.0.1molFe在点燃条件下与氧气反应时转移电子数目为0.3NA
D.0.4mol浓盐酸与足量的MnO2加热充分反应,产生Cl2的数目小于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饱和一元醇35.2g和足量的金属Na反应,生成标准状况下氢气为4.48L,该醇可氧化成醛,则其结构可能有几种( )
A.2种B.3种C.4种D.5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列关于NaOH溶液和氨水的说法正确的是( )
A.25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为20:1
B.pH=13的两溶液稀释100倍,pH都为11
C.两溶液中分别加入少量NH4Cl固体,c(OH )均减小
D.体积相同、pH相同的两溶液能中和等物质的量的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢叠氮酸(HN3)和莫尔盐[(NH4)2SO4·FeSO4·6H2O]是两种常用原料。
(1)氢叠氮酸易溶于水,25℃时,该酸的电离常数为Ka=10×10-5。
①氢叠氮酸在水溶液中的电离方程式为_______
②0.2mol/L的HN3溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃,此时,溶液呈酸性,则混合溶液中各离子和HN3分子浓度由大到小的顺序为_______。
(2)在FeSO4溶液中,加入(NH4)2SO4固体可制备莫尔盐晶体[(NH4)2Fe(SO4)2·6H2O],为了测定产品纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为cmol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如下:(已知莫尔盐的分子量为392)
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 25.52 | 25.02 | 24.98 |
①配制莫尔盐溶液,所使用的玻璃仪器除了烧杯和玻璃棒外还有_______
②滴定终点的现象是_______,通过实验数据,计算该产品的纯度为_______(用含字母a、c的式子表示)。
③上表第一次实验中记录数据明显大于后两次,其原因可能是_______。
A 第一次滴定时,锥形瓶用待装液润洗
B 该酸性高锰酸钾标准液保存时间过长,部分变质
C 滴定前酸式滴定管中尖嘴处有气泡,滴定结束后气泡消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是( )
A.除去Cl2中含有的少量HCl 
B.蒸干FeCl3饱和溶液制备FeCl3晶体
C.制取少量纯净的CO2气体
D.分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
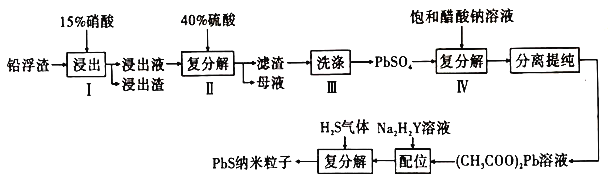
【题目】铅及其化合物用广泛,请回答下列相关问题:
(1)铅是碳的同族元素,比碳多4个电子层。铅元素的原子结构示意图为____________;相同温度下,同浓度的![]() 溶液和
溶液和![]() 溶液中水的电离程度___________(填“前者大”“后者大”或“一样大”)。
溶液中水的电离程度___________(填“前者大”“后者大”或“一样大”)。
(2)工业上利用锌冶炼过程中的铅浮渣(主要成分是![]() 、
、![]() ,含有少量
,含有少量![]() 、
、![]() 和其他不溶于硝酸的杂质)生产硫酸铅和硫化铅纳米粒子,流程如图所示:
和其他不溶于硝酸的杂质)生产硫酸铅和硫化铅纳米粒子,流程如图所示:
已知:a.25℃时,![]() ,
,![]() ,
,![]() 。
。
b.![]() 二钠简写成
二钠简写成![]() ,可以与
,可以与![]() 及其他许多金属离子形成稳定的配离子。
及其他许多金属离子形成稳定的配离子。
①已知步骤Ⅰ有![]() 产生,
产生,![]() 被足量稀硝酸氧化成
被足量稀硝酸氧化成![]() 。写出
。写出![]() 参加反应的离子方程式:________。
参加反应的离子方程式:________。
②步骤Ⅰ需控制硝酸的用量并使![]() 稍有剩余,原因是_________________________。
稍有剩余,原因是_________________________。
③硫酸铅微溶于水,醋酸铅易溶于水,步骤Ⅳ能发生反应的原因是____________________。
④不用硫化氢气体直接通入![]() 溶液来制备
溶液来制备![]() 纳米粒子的原因是__________________。
纳米粒子的原因是__________________。
⑤已知铅蓄电池工作时会产生![]() ,则铅蓄电池
,则铅蓄电池![]() 充电时的阳极反应式为________________________________。
充电时的阳极反应式为________________________________。
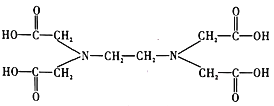
⑥![]() 又名乙二氨四乙酸,是一种弱酸(结构如图),在水溶液中可形成内盐(总电荷为0,电中性的化合物,但是带正电和负电的原子不同)。据此写出
又名乙二氨四乙酸,是一种弱酸(结构如图),在水溶液中可形成内盐(总电荷为0,电中性的化合物,但是带正电和负电的原子不同)。据此写出![]() 的结构:_________________。
的结构:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硝酸锶[Sr(NO3)2]可用于制造信号灯,光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如图:
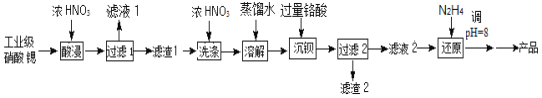
已知:①“滤渣1”的成份为Ba(NO3)2、Sr(NO3)2;②铬酸(H2CrO4)为二元弱酸
(1)用铬酸(H2CrO4)“沉钡”,是工业上常用的方法。H2CrO4中Cr元素的化合价为__,其在水中的电离方程式为___。
(2)“酸浸”不能采用高温的原因是__,“滤液1”的主要溶质是__(写化学式)。
(3)相对于水洗,用浓HNO3洗涤的优点是__。
(4)“滤液2”中过量的H2CrO4被N2H4还原为Cr3+,同时放出无污染的气体,写出发生反应的离子方程式__。
(5)已知Cr(OH)3类似氢氧化铝,还原后溶液的pH不能大于8的原因是(用离子方程式说明理由)__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com