
下列说法正确的是
A.O2的摩尔质量是32
B.摩尔是物质的量的单位
C.1 mol任何物质都约含有6.02x10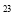 个原子
个原子
D.物质的量浓度为2mol/L的BaCl2溶液中,含有Cl-个数为4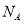 (
(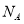 表示阿伏加德罗常数的值)
表示阿伏加德罗常数的值)
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014-2015学年宁夏高一上学期第一次月考化学试卷(解析版) 题型:填空题
(4分)就有关物质的分离回答下面的问题 (1)现有一瓶A和B的混合液,已知它们的性质如下表。
物质 | 熔点/oC | 沸点/oC | 密度/g·cm-3 | 溶解性 |
A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
B | 17.9 | 290 | 1.26 |
据此分析,将A和B相互分离的常用方法是:
(2)在分液漏斗中用一种有机溶剂萃取水溶液里的某物质时,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法。答:
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市和平区高二上学期期中考试化学试卷(解析版) 题型:选择题
强酸与强碱的稀溶液发生中和反应的热效应:
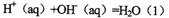
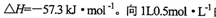 。向1L0.5mol的NaOH溶液中加入下列物质:①稀醋酸②浓硫酸 ③稀硝酸,恰好完全反应时的热效应
。向1L0.5mol的NaOH溶液中加入下列物质:①稀醋酸②浓硫酸 ③稀硝酸,恰好完全反应时的热效应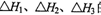 的关系正确的是
的关系正确的是

查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川邛崃市高二上学期第一次月考化学试卷(解析版) 题型:填空题
已知尿素的结构式为: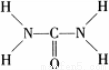 尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。
尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。
(1)C、N、O三种元素的第一电离能由大到小的顺序是__________;电负性由大到小顺序是__________。
(2)尿素分子中C和N原子的杂化方式分别是__________、__________。
(3)NH4+中H—N—H键角比NH3中H—N—H键角大,原因为__________________________________________________。
(4)美国科学家合成了结构呈“V”形的N5+,已知该离子中各原子均达到8电子稳定结构。则有关该离子的下列说法中正确的是__________。
A.每个N5+中含有35个质子和36个电子
B.该离子中有非极性键和配位键
C.该离子中含有2个π键
D.与PCl4+互为等电子体
(5)[Fe(H2NCONH2)6](NO3)3中H2NCONH2与Fe(Ⅲ)之间的作用力是__________。FeCl3溶液与KSCN溶液混合,得到含多种配合物的红色溶液,其中配位数为5的配合物的化学式是__________。KSCN中的阴离子与CO2互为等电子体,该阴离子的电子式是__________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川邛崃市高二上学期第一次月考化学试卷(解析版) 题型:选择题
应用元素周期律的有关知识可以预测我们不知道的一些元素及其化合物的性质。下列预测中不正确的是
①Be的氧化物的水化物可能具有两性,
②Tl能与盐酸和NaOH溶液作用均产生氢气,
③At单质为有色固体,AgAt不溶于水也不溶于稀硝酸,
④Li在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱,
⑤SrSO4是难溶于水的白色固体,
⑥H2Se是无色,有毒,比H2S稳定的气体
A.①②③④ B.②④⑥ C.①③⑤ D.②④⑤
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川邛崃市高三上学期第一次月考化学试卷(解析版) 题型:填空题
中航工业成都飞机工业(集团)有限责任公司为中国航空事业做出了巨大贡献,先后研制了歼5、歼教5、歼7、歼教7、歼10、枭龙等歼击机和教练机。银铜合金广泛应用于航空工业。从切割废料中回收银并制备铜的化工产品工艺如下:
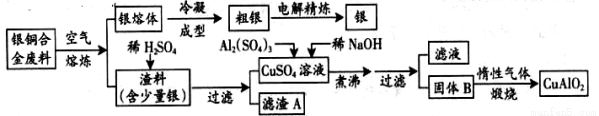
(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)电解精炼银时,阴极电极反应式为 ;
滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,将红棕色气体溶于水的化学方程式为 。
(2)固体混合物B的组成为 ;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为 。
(3)配平煅烧过程中一个反应的化学方程式:
CuO + Al2O3  CuAlO2 + ↑
CuAlO2 + ↑
(4)CuSO4溶液也可用于制备胆矾,其基本操作是 、 、过滤、洗涤和干燥。
(5)若银铜合金中铜的质量分数为63.5%,理论上5.0kg废料中的铜可完全转化为CuAlO2,至少需要1.0mol/L的Al2(SO4)3溶液 L。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高一10月月考化学试卷(解析版) 题型:填空题
(10分)(1)1.7g NH3共有 mol 原子;0.1mol CH4 在标准状况下含有的电子数为 ,体积约为 。在同温同压下,同体积的NH3和CH4的质量比为_____________;在同温同压下,同质量的NH3和CH4的体积比为______________。
(2)已知1.2g RSO4中含0.01molR2+,则RSO4的摩尔质量是 ;R的相对原子质量是 。
(3)如图所示是医院为病人输液时用的一瓶质量分数为5%的葡萄糖(其分子式为C6H12O6)注射液标签,则该溶液中含水的质量为 ;该溶液的密度约为 ;该溶液的溶质的物质的量浓度为 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com