
强酸与强碱的稀溶液发生中和反应的热效应:
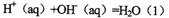
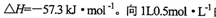 。向1L0.5mol的NaOH溶液中加入下列物质:①稀醋酸②浓硫酸 ③稀硝酸,恰好完全反应时的热效应
。向1L0.5mol的NaOH溶液中加入下列物质:①稀醋酸②浓硫酸 ③稀硝酸,恰好完全反应时的热效应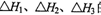 的关系正确的是
的关系正确的是

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源:2014-2015学年山东临沂商城实验学校高一10月学情调研考试化学卷(解析版) 题型:选择题
已知丙酮(C3H6O)通常是无色液体,易溶于水,密度小于1 g?mL﹣1,沸点约为55℃.要从水与丙酮的混合物中将丙酮分离出来,下列方法中最为合理的是( )
A.蒸馏 B.分液 C.过滤 D.蒸发
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏高一上学期第一次月考化学试卷(解析版) 题型:选择题
下列叙述正确的是( )
A.任何条件下,等物质的量的甲烷和一氧化碳所含的原子数一定相等
B.同温同压下,相同体积的物质,其物质的量一定相等
C. 1L甲烷气体一定比1L氧气的质量小
D.相同条件下的一氧化碳气体和氮气,若体积相等,则质量一定相等
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市和平区高二上学期期中考试化学试卷(解析版) 题型:填空题
(12分)高温下,炼铁高炉中存在下列平衡:
回答下列问题:
(1)写出该反应的平衡常数表达式_______________________________________。
(2)升高温度,该反应的平衡常数K值将__________(填“增大”、“减小”、“不变”),平衡体系中固体的质量将__________(填“增大”、“减小”、“不变”)。
(3)已知11OO℃时该反应的平衡常数K=0.263。在1100℃时,测得高炉中。
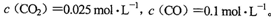 此时该的化学反应速度是v(正)___________(填“>”、“<”、“=”)v(逆),原因是_________________________________________________________________________。
此时该的化学反应速度是v(正)___________(填“>”、“<”、“=”)v(逆),原因是_________________________________________________________________________。
(4)保持高炉温度为1100℃,向高炉中补充大量的空气,重新达到平衡后,该反应的平衡常数K值 __________(填”>”、“<”、“=”)0.263。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市和平区高二上学期期中考试化学试卷(解析版) 题型:选择题
某反应过程中体系的能量变化如图所示,下列说法错误的是

A.反应过程可表示为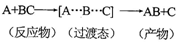
B.E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能
C.正反应的热效应为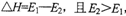 ,所以正反应为放热反应
,所以正反应为放热反应
D.此图中逆反应的热效应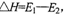 ,为吸热反应
,为吸热反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市和平区高二上学期期中考试化学试卷(解析版) 题型:选择题
对于反应2SO2(g)+O2(g) 2SO3(g),能增大正反应速率的措施是
2SO3(g),能增大正反应速率的措施是
A.增大容器容积 B.通入大量O2
C.移去部分SO3 D.降低体系温度
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市和平区高一上学期期中化学试卷(解析版) 题型:填空题
(10分)某工厂的工业废水中含有大量的Fe2+、SO42-和较多的Cu2+及少量的Na+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图,在方框和 括号内填写物质名称(或主要成分的化学式)或操作方法,完成回收硫酸亚铁和铜的简单实 验方案。
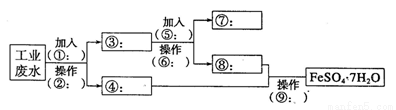
(1)操作②的名称为__________,所需要的玻璃仪器为__________、__________、烧杯。
(2)试剂⑤的化学式为__________,发生化学反应的离子方程式为__________。
(3)为验证溶液⑧中含有SO42-:取少量的溶液⑥于试管中,先加入____再加入__________,若观察到有白色沉淀,则说明溶液⑧中含有SO42-。写出上述反应的离子方程式______________________________.
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市和平区高一上学期期中化学试卷(解析版) 题型:选择题
下列说法正确的是
A.O2的摩尔质量是32
B.摩尔是物质的量的单位
C.1 mol任何物质都约含有6.02x10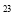 个原子
个原子
D.物质的量浓度为2mol/L的BaCl2溶液中,含有Cl-个数为4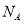 (
(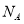 表示阿伏加德罗常数的值)
表示阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省邛崃市高二上学期半期考试化学试卷(解析版) 题型:填空题
(15分)下面的表格是元素周期表的一部分,其中的序号对应的是元素。
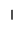
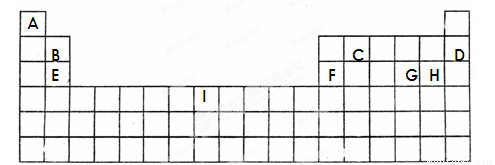
请回答下列问题:
(1)按原子轨道的重叠方式看,元素A、C形成的相对分子质量最小的分子含 键;元素E和H形成的化学键类型为 。
(2)上表中所列举的某元素最外电子层上p电子数比s电子数少1,则该元素的元素符号为
(3)B、D、E、F四种元素的第一电离能由大到小的顺序是(填元素符号) 。
(4)元素I的价电子排布式为 。I元素通常情况下能形成两种离子,其中较稳定的是 ,其原因是 。
(5)硒(se)是人体必需的微量元素,与G同一主族,Se原子比G原子多一个电子层。则:Se的原子序数为_______,其原子结构示意图为 。
(6)G、H两元素能形成G2H2,它是一种琥珀色液体,是合成硫化染料的重要原料。它的熔点-80℃,沸点138℃。常温下,它遇水易反应,产生使品红褪色的气体,且溶液出现浑浊。
①S2Cl2遇水反应产生气体,该气体分子是 (填“极性”或“非极性”)分子。
② 写出二氯化硫与水反应的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com