
(12分)高温下,炼铁高炉中存在下列平衡:
回答下列问题:
(1)写出该反应的平衡常数表达式_______________________________________。
(2)升高温度,该反应的平衡常数K值将__________(填“增大”、“减小”、“不变”),平衡体系中固体的质量将__________(填“增大”、“减小”、“不变”)。
(3)已知11OO℃时该反应的平衡常数K=0.263。在1100℃时,测得高炉中。
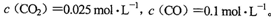 此时该的化学反应速度是v(正)___________(填“>”、“<”、“=”)v(逆),原因是_________________________________________________________________________。
此时该的化学反应速度是v(正)___________(填“>”、“<”、“=”)v(逆),原因是_________________________________________________________________________。
(4)保持高炉温度为1100℃,向高炉中补充大量的空气,重新达到平衡后,该反应的平衡常数K值 __________(填”>”、“<”、“=”)0.263。
(1) K= (2)增大;减小; (3) > Q=0.025/0.1=0.25<K=0.263,平衡正向移动,正反应速率大于逆反应速率 (4)=
(2)增大;减小; (3) > Q=0.025/0.1=0.25<K=0.263,平衡正向移动,正反应速率大于逆反应速率 (4)=
【解析】
试题分析:(1)FeO(s)+CO(g)?Fe(s)+CO2(g)的平衡常数K= ;
;
(2)该反应是吸热反应,升高温度,化学平衡正向移动,该反应的平衡常数K值将增大,生成的固体铁的质量会比原来氧化亚铁的质量少;
(3)因为此时Q=0.025/0.1=0.25<K=0.263,反应没有处于平衡状态,反应是向正反应方向进行的,因此正反应速率大于逆反应速率。(4)K只受温度影响,温度不变,K不变,等于0.263。
考点:考查化学平衡常数,化学反应速率等知识。


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源:2014-2015学年山东临沂商城实验学校高一10月学情调研考试化学卷(解析版) 题型:选择题
NA为阿伏加德罗常数,下列说法中正确的是( )
A.标准状况下,22.4LH2O所含有原子数为3NA
B.1mol OH﹣中含电子数目为9NA
C.标准状况下,11.2LN2和O2的混合气体所含的原子数为NA
D.1mol/L MgSO4溶液中所含SO42﹣数目为NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏高一上学期第一次月考化学试卷(解析版) 题型:填空题
(4分)就有关物质的分离回答下面的问题 (1)现有一瓶A和B的混合液,已知它们的性质如下表。
物质 | 熔点/oC | 沸点/oC | 密度/g·cm-3 | 溶解性 |
A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
B | 17.9 | 290 | 1.26 |
据此分析,将A和B相互分离的常用方法是:
(2)在分液漏斗中用一种有机溶剂萃取水溶液里的某物质时,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法。答:
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏高一上学期第一次月考化学试卷(解析版) 题型:选择题
下列事故处理方法正确的是
A. 汽油失火时,立即用水灭火
B. 电线短路失火时,要用泡沫灭火器灭火
C. 浓 NaOH 溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液
D. 浓硫酸溅到皮肤上,立即用稀 NaOH 溶液洗涤
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏高一上学期第一次月考化学试卷(解析版) 题型:选择题
下列叙述中正确的是
A.一摩尔碳
B.1molH+
C.1mol氧含6.02×1023个O2分子
D.硫酸的摩尔质量是98
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市和平区高二上学期期中考试化学试卷(解析版) 题型:选择题
某密闭容器中充入等物质的量的A和B,一定温度下发生反应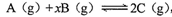 ,达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确的是
,达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确的是
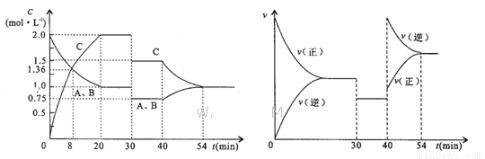
A.30 min时降低温度,40 min时升高温度
B.反应方程式中的x=1,正反应为吸热反应
C.8 min前A的平均反应速率为0.08 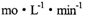
D.30 min~40 min间该反应一定使用了催化剂
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市和平区高二上学期期中考试化学试卷(解析版) 题型:选择题
强酸与强碱的稀溶液发生中和反应的热效应:
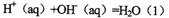
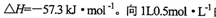 。向1L0.5mol的NaOH溶液中加入下列物质:①稀醋酸②浓硫酸 ③稀硝酸,恰好完全反应时的热效应
。向1L0.5mol的NaOH溶液中加入下列物质:①稀醋酸②浓硫酸 ③稀硝酸,恰好完全反应时的热效应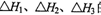 的关系正确的是
的关系正确的是

查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川邛崃市高三上学期第一次月考化学试卷(解析版) 题型:填空题
中航工业成都飞机工业(集团)有限责任公司为中国航空事业做出了巨大贡献,先后研制了歼5、歼教5、歼7、歼教7、歼10、枭龙等歼击机和教练机。银铜合金广泛应用于航空工业。从切割废料中回收银并制备铜的化工产品工艺如下:
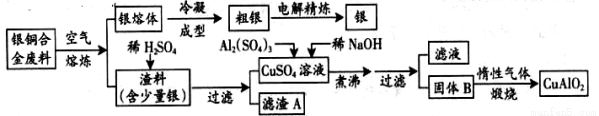
(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)电解精炼银时,阴极电极反应式为 ;
滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,将红棕色气体溶于水的化学方程式为 。
(2)固体混合物B的组成为 ;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为 。
(3)配平煅烧过程中一个反应的化学方程式:
CuO + Al2O3 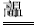 CuAlO2 + ↑
CuAlO2 + ↑
(4)CuSO4溶液也可用于制备胆矾,其基本操作是 、 、过滤、洗涤和干燥。
(5)若银铜合金中铜的质量分数为63.5%,理论上5.0kg废料中的铜可完全转化为CuAlO2,至少需要1.0mol/L的Al2(SO4)3溶液 L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com