
(15分)下面的表格是元素周期表的一部分,其中的序号对应的是元素。
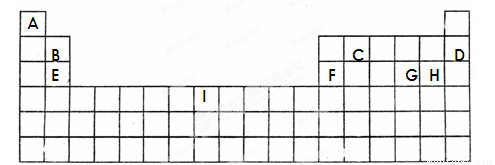
请回答下列问题:
(1)按原子轨道的重叠方式看,元素A、C形成的相对分子质量最小的分子含 键;元素E和H形成的化学键类型为 。
(2)上表中所列举的某元素最外电子层上p电子数比s电子数少1,则该元素的元素符号为
(3)B、D、E、F四种元素的第一电离能由大到小的顺序是(填元素符号) 。
(4)元素I的价电子排布式为 。I元素通常情况下能形成两种离子,其中较稳定的是 ,其原因是 。
(5)硒(se)是人体必需的微量元素,与G同一主族,Se原子比G原子多一个电子层。则:Se的原子序数为_______,其原子结构示意图为 。
(6)G、H两元素能形成G2H2,它是一种琥珀色液体,是合成硫化染料的重要原料。它的熔点-80℃,沸点138℃。常温下,它遇水易反应,产生使品红褪色的气体,且溶液出现浑浊。
①S2Cl2遇水反应产生气体,该气体分子是 (填“极性”或“非极性”)分子。
② 写出二氯化硫与水反应的化学方程式 。
(15分)
(1)σ;离子键。(各1分)
(2)Al (2分)
(3)Ne>Be>Mg>Al (2分)
(4)3d64S2,Fe3+,Fe3+的价电子层为3d5,半充满较稳定(各1分)
(5)34,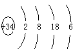 (各1分)
(各1分)
(6)①极性(2分)
②2 S2Cl2+2H2O=SO2↑+4HCl+3S↓(2分)
【解析】
试题分析:(1)A是H元素,C是C元素,二者形成的相对分子质量最小的分子是甲烷分子,所以甲烷分子中存在σ键;Mg与Cl形成氯化镁,是离子化合物,含有离子键;
(2)某元素最外电子层上p电子数比s电子数少1,则外围电子的电子排布应是ns2np1,所以是第三主族元素,根据元素的分布,所以是Al元素;
(3)同周期元素中,随核电荷数的增多第一电离能逐渐增大,但Mg的最外层是半充满状态,所以第一电离能大于Al,稀有气体的第一电离能最大,同主族元素,从上到下,第一电离能逐渐减小,所以四种元素的第一电离能从大到小的顺序是Ne>Be>Mg>Al;
(4)I是Fe元素,价电子的排布式是3d64S2,Fe失去3个电子,形成半充满的稳定结构,所以较稳定的离子是Fe3+;
(5)G在S元素的下一周期,原子序数比S大18,所以Se的原子序数是34,原子结构示意图为 ;
;
(6)①S2Cl2遇水反应产生气体,能使品红溶液褪色,所以该气体是二氧化硫气体,二氧化硫是极性分子;
②根据题意S2Cl2遇水反应产生气体,且使溶液浑浊,说明产生二氧化硫气体,S元素的化合价升高,而在该反应中可以是沉淀的只能是S单质了,所以S元素的化合价发生变化,根据元素守恒,产物中还有HCl,所以反应的化学方程式为2 S2Cl2+2H2O=SO2↑+4HCl+3S↓。
考点:考查元素周期表的应用,元素及其化合物的性质判断,化学用语的书写


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源:2014-2015学年天津市和平区高二上学期期中考试化学试卷(解析版) 题型:选择题
强酸与强碱的稀溶液发生中和反应的热效应:
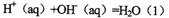
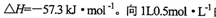 。向1L0.5mol的NaOH溶液中加入下列物质:①稀醋酸②浓硫酸 ③稀硝酸,恰好完全反应时的热效应
。向1L0.5mol的NaOH溶液中加入下列物质:①稀醋酸②浓硫酸 ③稀硝酸,恰好完全反应时的热效应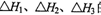 的关系正确的是
的关系正确的是

查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川邛崃市高二上学期第一次月考化学试卷(解析版) 题型:选择题
应用元素周期律的有关知识可以预测我们不知道的一些元素及其化合物的性质。下列预测中不正确的是
①Be的氧化物的水化物可能具有两性,
②Tl能与盐酸和NaOH溶液作用均产生氢气,
③At单质为有色固体,AgAt不溶于水也不溶于稀硝酸,
④Li在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱,
⑤SrSO4是难溶于水的白色固体,
⑥H2Se是无色,有毒,比H2S稳定的气体
A.①②③④ B.②④⑥ C.①③⑤ D.②④⑤
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川邛崃市高三上学期第一次月考化学试卷(解析版) 题型:填空题
中航工业成都飞机工业(集团)有限责任公司为中国航空事业做出了巨大贡献,先后研制了歼5、歼教5、歼7、歼教7、歼10、枭龙等歼击机和教练机。银铜合金广泛应用于航空工业。从切割废料中回收银并制备铜的化工产品工艺如下:
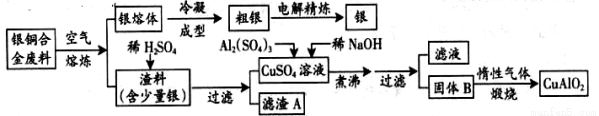
(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)电解精炼银时,阴极电极反应式为 ;
滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,将红棕色气体溶于水的化学方程式为 。
(2)固体混合物B的组成为 ;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为 。
(3)配平煅烧过程中一个反应的化学方程式:
CuO + Al2O3 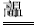 CuAlO2 + ↑
CuAlO2 + ↑
(4)CuSO4溶液也可用于制备胆矾,其基本操作是 、 、过滤、洗涤和干燥。
(5)若银铜合金中铜的质量分数为63.5%,理论上5.0kg废料中的铜可完全转化为CuAlO2,至少需要1.0mol/L的Al2(SO4)3溶液 L。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川邛崃市高三上学期第一次月考化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,22.4 L三氧化硫含有的分子数为NA
B.39克过氧化钠与足量的二氧化碳反应转移的电子数为NA
C.常温常压下,28克乙烯和环丙烷的混合气体中含有的碳原子数为2 NA
D.某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省邛崃市高二上学期半期考试化学试卷(解析版) 题型:选择题
SCR法(选择性催化还原技术)是一种以NH3作为还原剂,将烟气中NOx分解成无害的N2和H2O的干法脱硝技术,反应原理为:①6NO+4NH3===5N2+6H2O;②6NO2+8NH3===7N2+12H2O;③NO+NO2+2NH3===2N2+3H2O。下列说法正确的是
A.汽车尾气中含有NOx,NOx是引起温室效应的主要气体之一
B.N2中π键与σ键之比为1:2
C.反应③中每生成标况下的22.4 L N2转移电子数1.5NA
D.NH3的沸点比PH3的沸点高
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省邛崃市高二上学期半期考试化学试卷(解析版) 题型:选择题
下列关于杂化轨道的叙述中,不正确的是
A.分子中中心原子通过sp2杂化轨道成键时,该分子不一定为平面三角形结构
B.杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子
C.N2分子中N原子没有杂化,分子中有1个σ键、2个π键
D.H2SO4分子中三种原子均以杂化轨道成键
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高一10月月考化学试卷(解析版) 题型:填空题
(10分)(1)1.7g NH3共有 mol 原子;0.1mol CH4 在标准状况下含有的电子数为 ,体积约为 。在同温同压下,同体积的NH3和CH4的质量比为_____________;在同温同压下,同质量的NH3和CH4的体积比为______________。
(2)已知1.2g RSO4中含0.01molR2+,则RSO4的摩尔质量是 ;R的相对原子质量是 。
(3)如图所示是医院为病人输液时用的一瓶质量分数为5%的葡萄糖(其分子式为C6H12O6)注射液标签,则该溶液中含水的质量为 ;该溶液的密度约为 ;该溶液的溶质的物质的量浓度为 。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都外国语学校高二上学期期中化学试卷(解析版) 题型:选择题
下列有关晶体的说法中一定正确的是
①原子晶体中只存在非极性共价键
②稀有气体形成的晶体属于原子晶体
③干冰晶体升华时,分子内共价键会发生断裂
④金属元素和非金属元素形成的化合物一定是离子化合物
⑤分子晶体的堆积均为分子密堆积
⑥离子晶体和金属晶体中均存在阳离子,但金属晶体中却不存在离子键
⑦金属晶体和离子晶体都能导电
⑧依据构成粒子的堆积方式可将晶体分为金属晶体、离子晶体、分子晶体、原子晶体
A.①③⑦ B.只有⑥ C.②④⑤⑦ D.⑤⑥⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com