
【题目】在密闭容器中发生下列反应aA(g) ![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A. A的转化率变大
B. 平衡向正反应方向移动
C. D的体积分数变大
D. a < c+d
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列关于氧化钠和过氧化钠的叙述中正确的是
A. 都能与氧气反应 B. 溶于水后,所得溶液的成分相同
C. 都能与水发生化合反应 D. 分别与二氧化碳反应,生成不同的盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾是活泼的碱金属,钾和氧有氧化钾(K2O)、过氧化钾(K2O2)和超氧化钾(KO2)等多种化合物.
(1)钾和硝酸钾反应可制得K2O(10K+2KNO3→6K2O+N2),39.0g钾与10.1g硝酸钾充分反应生成K2O的质量为g.
(2)某过氧化钾样品中氧的质量分数(杂质不含氧)为0.28,则样品中K2O2的质量分数为 .
(3)超氧化钾和二氧化碳反应生成氧气(4KO2+2CO2→2K2CO3+3O2),在医院、矿井、潜水、高空飞行中用作供氧剂.13.2L(标准状况)CO2和KO2反应后,气体体积变为18.8L (标准状况),计算反应消耗的KO2的质量.
(4)KO2加热至600℃部分分解得到产物A.6.30g产物A充分吸收二氧化碳生成碳酸钾并产生氧气1.12L(标准状况),试确定产物A中钾氧两种原子个数之比.如果产物A只含有两种化合物,写出所有可能的化学式并计算A中两种化合物的物质的量之比.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质的转化关系如图所示,其中甲、乙为单质,丙、丁为化合物. 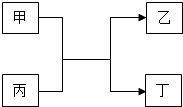
①若工业上用该反应制粗硅写出该反应的化学方程式: .
②若该反应可用于焊接铁轨且丙为红棕色固体则该反应的化学方程式为: .
③若丁为具有磁性的黑色晶体写出该反应的化学方程式: .
④若甲为黄绿色气体,且该反应用来检验工业上甲是否泄漏,写出该反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知实验室在加热条件下制取Cl2的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。现将8.7 g MnO2投入到200 g质量分数为36.5%(过量)的浓盐酸中加热,充分反应后,求:
MnCl2+Cl2↑+2H2O。现将8.7 g MnO2投入到200 g质量分数为36.5%(过量)的浓盐酸中加热,充分反应后,求:
(1)标准状况下生成Cl2的体积。
(2)反应生成的MnCl2的质量为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g) ![]() 2Z(g)+W(s) ΔH<0,下列叙述正确的是
2Z(g)+W(s) ΔH<0,下列叙述正确的是
A. 达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动
B. 达到平衡后,降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数
C. 达到平衡时,反应速率v正(X)=2v逆(Z)
D. 平衡常数K值越大,X的转化率越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学式为C3H6Cl2的有机物,若再有一个氢原子被氯原子取代,则产物有两种可能的结构,原有机物的结构简式为( )
A.CH2Cl﹣CH2﹣CH2Cl
B.CHCl2﹣CH2﹣CH3
C.CH2Cl﹣CHCl﹣CH3
D.CH3﹣CCl2﹣CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法错误的是
A.碳酸氢钠可用于焙制糕点
B.木材纤维和土豆淀粉遇碘水均显蓝色
C.漂白粉可用于游泳池用水的消毒
D.聚乙烯塑料可用于制造包装材料、农用薄膜等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com