
【题目】化学与生活密切相关,下列说法错误的是
A.碳酸氢钠可用于焙制糕点
B.木材纤维和土豆淀粉遇碘水均显蓝色
C.漂白粉可用于游泳池用水的消毒
D.聚乙烯塑料可用于制造包装材料、农用薄膜等
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
【题目】在密闭容器中发生下列反应aA(g) ![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A. A的转化率变大
B. 平衡向正反应方向移动
C. D的体积分数变大
D. a < c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g),是工业制硫酸的主要反应之一。
2SO3(g),是工业制硫酸的主要反应之一。
(1)该反应过程的能量变化如图所示:

由图中曲线变化可知,该反应为______(填“放热”或“吸热”)反应。该反应通常用V2O5作催化剂,加入V2O5后,改变的是图中的_____。
A.△H B.E C.△H-E D.△H+E
(2)在2L绝热密闭容器中投入2molSO2和bmolO2,下图是部分反应物随时间的变化曲线。

①10min时,v(SO3)=_____。
②反应达到平衡时,SO2的转化率为______。
③下列情况能说明该反应达到化学平衡的是_____
A. v(SO3)=v(SO2) B.混合气体的密度保持不变
C.t时刻,体系的温度不再发生改变 D.混合气体的总物质的量不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,设计了如图所示装置进行有关实验: 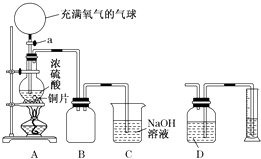
(1)先关闭活塞a,将6.4g铜片和10mL 18mol/L的浓硫酸放在圆底烧瓶中共热至反应完成,发现烧瓶中还有铜片剩余.再打开活塞a,将气球中的氧气缓缓挤入圆底烧瓶,最后铜片完全消失. ①写出上述过程中圆底烧瓶内发生反应的化学方程式:
打开活塞a之前;
打开活塞a之后 .
②B是用来收集实验中产生的气体的装置,但集气瓶内的导管未画全,请直接在图上把导管补充完整.
(2)实际上,在打开活塞a之前硫酸仍有剩余.为定量测定余酸的物质的量,甲、乙两学生进行了如下设计: ①甲学生设计的方案是:先测定铜与浓硫酸反应产生SO2的量,再通过计算确定余酸的物质的量.他测定SO2的方法是将装置A产生的气体缓缓通过装置D,从而测出装置A产生气体的体积(已折算成标准状况下).你认为甲学生设计的实验方案中D装置中的试剂为(填化学式).
②乙学生设计的方案是:将反应后的溶液冷却后全部移入到烧杯中稀释,并按正确操作配制100mL溶液,再取20mL于锥形瓶中,用作指示剂,用标准氢氧化钠溶液进行滴定[已知:Cu(OH)2开始沉淀的pH约为5],选择该指示剂的理由为;再求出余酸的物质的量,若耗去a mol/L氢氧化钠溶液b mL,则原余酸的物质的量为mol(用含a、b的表达式来表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,A、B反应生成C和D,在2L的密闭容器中进行,起始时加入了4molA和2molB,经过一段时间达到反应限度,测得C的浓度为1mol/L,D的平均反应速率为0.2 mol·L-·min-,A与B都反应了50%,且D与A的化学计量数相同,请回答下列问题:
(1)达到反应限度这段时间内A的反应速率为______________。
(2)写出该反应的化学方程式:________________________________。
(3)达到化学反应限度所用的时间为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合草酸亚铁(FeC2O4·xH2O)是生产锂电池的原料,难溶于水,受热易分解。某化学兴趣小组对草酸亚铁的一些性质进行探究。回答下列问题:
(1)实验室用硫酸亚铁溶液和草酸制备水合草酸亚铁,反应的化学方程式是_________。
(2)将水合草酸亚铁溶于适量盐酸。分别取2 mL此溶液于3支试管中,进行实验:
①第一支试管中加入几滴KSCN溶液,溶液不变红;
②第二支试管中加入几滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入几滴酸性KMnO4溶液,溶液紫红色褪去。
上述实验能证明水合草酸亚铁中存在Fe2+的是_________(填编号)。
(3)为测定水合草酸亚铁中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为m2 g。按下图连接好装置进行实验。
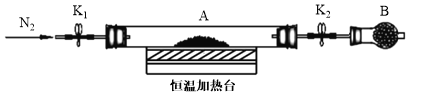
验步骤如下:a.打开K1和K2,缓缓通入N2;b.加热装置A一段时间;c.停止加热,冷却到室温;d.关闭K1和K2,称量A;e.重复上述步骤,直至A恒重,记为m3 g。
①步骤b至步骤c继续通入N2的目的是 ________________。
②根据实验数据记录,计算水合草酸亚铁化学式中结晶水数目x=______(列式表示)。
(4)为探究草酸亚铁的分解产物,将(3)中已恒重的装置A接入下图所示部分的装置(可重复选用)进行实验。打开K1和K2,缓缓通入N2,充分加热。实验后石英玻璃管中固体仅残留一种有磁性的黑色化合物。
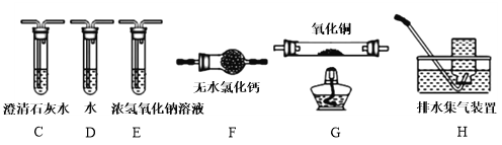
①写出草酸亚铁受热分解的化学方程式____________。
②实验装置中,依次连接的合理顺序为A、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】参照反应Br+H2HBr+H的能量对反应历程的示意图,下列叙述中正确的是( ) 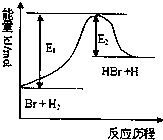
A.正反应为放热反应
B.加入催化剂,该化学反应的反应热变大
C.反应物总能量低于生成物总能量
D.升高温度可增大正反应速率,降低逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】六种短周期元素在周期表中的相对位置如下所示,其中E元素原子核外电子总数是其最外层电子数的3倍。关于元素周期表及这六种元素性质,请回答:

(1)这六种元素的氢化物中,最稳定的是___________.(写化学式);
(2)AF2的结构式为_____________.
(3)在一定条件下,由B单质与H2反应生成1 molG气体时,放出的热量为46.2 kJ,写出该反应的热化学方程式:_____________________.
(4)工业上用G检验输送氯气的管道是否漏气,可观察到大量白烟,同时有单质B生成,写出化学方程式__________________________.该反应中被氧化的G与参与反应的G的质量之比__________.
(5)F的单质可由其氧化物与氢化物反应生成,写出该反应的化学方程式:__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D同族,C的简单离子和B的简单离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物中阴阳离子的个数比为1:1。根据判断出的元素及相应化学式回答问题:
(1)五种元素中,金属性最强的是_______(填元素名称),非金属性最强的元素是_____(填元素名称)。
(2)由元素A分别和元素B、D、E所形成的共价型化合物中,热稳定性最差的是________________________________________(用化学式表示)。
(3)元素A和E形成的化合物与元素A和B形成的化合物反应,产物的电子式为____________,其中存在的化学键类型为_________________________。
(4)E离子的结构示意图是_______________。单质E与水反应的离子方程式为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com