
【题目】李时珍在《本草纲目》中写到“烧酒非古法也,自元时始创其法。用浓酒精和糟入甑,蒸令气上,用器承取滴露。”文中涉及的操作方法是
A.分液B.萃取C.过滤D.蒸馏
 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)下列所给出的几组物质中:含有分子数最少的是________________;标准状况下体积最小的是_____________________。
①1gH2 ②2.408×1023个CH4分子 ③10.8gH2O ④标准状况下6.72LCO2
(2)请配平方程式:___KClO3+____HCl(浓)=___KC1+____ ClO2↑+___Cl2↑+__H2O,__________
(3)溶液导电能力取决于自由移动离子的浓度和所带电荷数,离子浓度越大,所带电荷数越多,溶液导电能力越强。现有浓度均为lmol/L的以下电解质溶液:①K2CO3 ②AgNO3 ③NaHSO4 ④Al2(SO4)3⑤H2SO4 ⑥Ba(OH)2。这些溶液中导电能力最强的是__________(填序号),导电能力最弱的是____________。
(4)有12.4gNa2R含Na+为0.4mol,则Na2R的摩尔质量为____________。
(5)在0.2L由NaCl溶液、MgCl2溶液、CuCl2溶液组成的混合溶液中,部分离子的浓度如图所示。该混合溶液中CuCl2的物质的量浓度为____________ molL-1。

(6)下图所示的警示标志,是一种____________(填选项序号)。

A.易燃品 B.剧毒品 C.腐蚀品 D.爆炸品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化物是一类重要化合物,氢叠氮酸(HN3)是一种弱酸,如图为分子结构示意图1.肼(N2H4)被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2═2H2O+HN3 . 它的酸性类似于醋酸,可微弱电离出H+和N3﹣ . 
试回答下列问题:
(1)下列说法正确的是(选填序号).
A.酸性:HNO2>HNO3
B.N2H4中两个氮原子采用的都是sp2杂化
C.HN3、H2O都是极性分子
D.N2H4沸点高达113.5℃,说明肼分子间可形成氢键
(2)叠氮化物能与Fe3+、Cu2+及Co3+等形成配合物,如:[Co(N3)(NH3)5]SO4 , 在该配合物中钴显价,根据价层电子对互斥理论可知SO42﹣的立体构型为 , 写出钴原子在基态时的核外电子排布式: .
(3)由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)═2Na(l)+3N2(g),下列说法正确的是(选填序号).
A.NaN3与KN3结构类似,前者晶格能较小
B.钠晶胞结构如图2,晶胞中分摊2个钠原子
C.氮的第一电离能大于氧
D.氮气常温下很稳定,是因为氮元素的电负性小
(4)与N3﹣互为等电子体的分子有:(举两例).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机玻璃是一种高分子化合物,在工业上和生活中有着广泛用途,工业上合成有机玻璃流程为:

下列说法不正确的是
A. 反应①的原子利用率达100%
B. 反应②是加聚反应
C. 相对分子质量为86,且与甲基丙烯酸甲酯具有相同官能团的有机物有5种
D. 甲基丙烯酸甲酯能使酸性高锰酸钾褪色,也能使Br2/CCl4褪色,二者原理相同
【答案】D
【解析】A、反应①为加成反应,没有副产物,则原子利用率为100%,选项A正确;B、反应②为碳碳双键发生的加聚反应,该反应为: ,选项B正确;C、相对分子质量为86,且与甲基丙烯酸甲酯[CH2=C(CH3)COOCH3]具有相同官能团的有机物应该含有一个酯基和一个碳碳双键且碳原子数为4,有HCOOCH=CHCH3、HCOOCH2CH=CH2、CH3COOCH=CH2、CH2=CHCOOCH3、HCOOC(CH3)=CH2共5种,选项C正确;D、甲基丙烯酸甲酯能被酸性高锰酸钾氧化而使其褪色,也能与溴发生加成反应而使Br2的CCl4溶液褪色,二者原理不相同,选项D不正确。答案选D。
,选项B正确;C、相对分子质量为86,且与甲基丙烯酸甲酯[CH2=C(CH3)COOCH3]具有相同官能团的有机物应该含有一个酯基和一个碳碳双键且碳原子数为4,有HCOOCH=CHCH3、HCOOCH2CH=CH2、CH3COOCH=CH2、CH2=CHCOOCH3、HCOOC(CH3)=CH2共5种,选项C正确;D、甲基丙烯酸甲酯能被酸性高锰酸钾氧化而使其褪色,也能与溴发生加成反应而使Br2的CCl4溶液褪色,二者原理不相同,选项D不正确。答案选D。
【题型】单选题
【结束】
4
【题目】按如图各装置进行实验能成功完成相应实验的是

A. 图1:证明非金属性强弱:C>Si B. 图2:制备氢氧化亚铁
C. 图3:分离碘并回收苯 D. 图4:制取和收集乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是原子序数依次增大的短周期主族元素。E是同周期元素金属性最强的元素。甲、乙、丙、丁、戊是由上述部分元素中的两种或几种组成的化合物,它们的转化关系如图所示。其中甲是生活中的调味品,丁是淡黄色固体。下列说法不正确的是
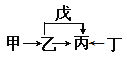
A. 原子半径由大到小的顺序为:r(E)>r(F)>r(C)>r(D)
B. 元素F的氧化物的水物化的酸性一定比硫酸酸性强
C. 元素B的氢化物可能具有正四面体结构
D. 化合物A4BC2D既可能是共价化合物,也可是离子化合物
【答案】B
【解析】A、B、C、D、E、F是原子序数依次增大的短周期主族元素。E是同周期元素金属性最强的元素,则E为钠元素;根据流程图推导,且甲是生活中的调味品,丁是淡黄色固体,可知甲为氯化钠,丁为过氧化钠,则丙为碳酸钠,乙为氢氧化钠,戊是二氧化碳,则A、B、C、D、E、F分别为H、C、N、O、Na、Cl。A. 同周期性元素从左到右原子半径逐渐减小,同主族元素从上而下原子半径逐渐增大,故原子半径由大到小的顺序为:r(Na)>r(Cl)>r(N)>r(O),选项A正确;B. 元素Cl的最高价氧化物的水物化的酸性一定比硫酸酸性强,若不是最高价氧化物的水化物,则可能比较弱,如HClO是弱酸,选项B不正确;C. 元素B的氢化物CH4具有正四面体结构,选项C正确;D. 化合物A4BC2D既可能是共价化合物CO(NH2)2,也可是离子化合物NH4CNO,选项D正确。答案选B。
【题型】单选题
【结束】
6
【题目】下图所示装置可间接氧化工业废水中含氮离子(NH4+)。下列说法不正确的是

A. 乙是电能转变为化学能的装置
B. 含氮离子氧化时的离子方程式为:3Cl2 + 2NH4+=N2 + 6Cl-+8H+
C. 若生成H2和N2的物质的量之比为3:1,则处理后废水的pH减小
D. 电池工作时,甲池中的Na+移向Mg电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按下图所示的装置进行实验,A、B为两种常见金属,它们的硫酸盐可溶于水。当K闭合时,在交换膜处SO![]() 从右向左移动。下列分析正确的是
从右向左移动。下列分析正确的是

A. 溶液中A2+浓度减小
B. B电极的反应:B-2e-===B2+
C. Y电极上有H2产生,发生还原反应
D. 反应初期,X电极周围出现白色胶状沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将Ⅰ阀关闭,Ⅱ阀打开,让一种含氯气的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是
①浓硫酸 ②饱和氯化钠溶液 ③NaOH溶液 ④饱和碳酸钠溶液 ⑤水

A. ①③ B. ②⑤ C. ②③⑤ D. ①③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com