
【题目】已知反应A2(g) + 2B2(g)![]() 2AB2(g) ΔH < 0,列说法正确的是 ( )
2AB2(g) ΔH < 0,列说法正确的是 ( )
A.升高温度,正向反应速率增加,逆向反应速率减小
B.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.升高温度有利于反应速率增加,从而缩短达到平衡的时间
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】铬是一种银白色金属,化学性质稳定,在化合物中常见![]() 、
、![]() 和
和![]() 价等价态。工业上以铬铁矿
价等价态。工业上以铬铁矿![]() 主要成分为
主要成分为![]() ,含有
,含有![]() 、
、![]() 等杂质
等杂质![]() 为主要原料生产金属铬和重铬酸钠
为主要原料生产金属铬和重铬酸钠![]() 已知
已知 ![]() 是一种强氧化剂
是一种强氧化剂![]() ,其主要工艺流程如下:
,其主要工艺流程如下:
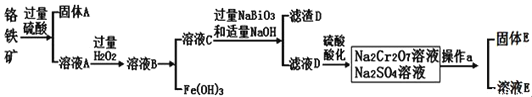
查阅资料得知:常温下,![]() 不溶于水,有强氧化性,在碱性条件下,能将
不溶于水,有强氧化性,在碱性条件下,能将![]() 转化为
转化为![]()
回答下列问题:
![]() 工业上常采用热还原法制备金属铬,写出以
工业上常采用热还原法制备金属铬,写出以![]() 为原料,利用铝热反应制取金属铬的化学方程式_______________。
为原料,利用铝热反应制取金属铬的化学方程式_______________。
![]() 酸化滤液D时,不选用盐酸的原因是_____________。
酸化滤液D时,不选用盐酸的原因是_____________。
![]() 固体E的主要成分是
固体E的主要成分是![]() ,根据如图分析操作a为________________、____________、洗涤、干燥。
,根据如图分析操作a为________________、____________、洗涤、干燥。
![]() 已知含
已知含![]() 价铬的污水会污染环境,电镀厂产生的镀铜废水中往往含有一定量的
价铬的污水会污染环境,电镀厂产生的镀铜废水中往往含有一定量的![]() 。
。
![]()
![]() 的化学性质与
的化学性质与 ![]() 相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为________
相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为________![]() 用离子方程式表示
用离子方程式表示![]() ;
;
![]() 下列溶液中可以代替上述流程中
下列溶液中可以代替上述流程中![]() 溶液最佳的是___________
溶液最佳的是___________![]() 填选项序号
填选项序号![]() ;
;
A ![]() 溶液
溶液 ![]() 浓
浓![]()
![]() 酸性
酸性![]() 溶液
溶液 ![]() 溶液
溶液
![]() 上述流程中,每消耗
上述流程中,每消耗![]() 转移
转移![]() ,则加入
,则加入![]() 溶液时发生反应的离子方程式为_____________。
溶液时发生反应的离子方程式为_____________。
![]() 某厂废水中含
某厂废水中含![]() 的
的![]() ,某研究性学习小组为了变废为宝,将废水处理得到磁性材料
,某研究性学习小组为了变废为宝,将废水处理得到磁性材料 ![]() 的化合价为
的化合价为![]() ,Fe的化合价依次为
,Fe的化合价依次为![]() 、
、![]() 。欲使1L该废水中的
。欲使1L该废水中的 ![]() 完全转化为
完全转化为![]() 。理论上需要加入________
。理论上需要加入________![]() 。
。
![]() 已知
已知![]() 摩尔质量为
摩尔质量为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100 mL 0.2 mol·L-1的氨水中逐滴加入0.2 mol·L-1的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O的物质的量分数与加入盐酸的体积的关系如图所示。
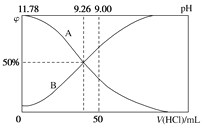
根据图象回答下列问题。
(1)表示NH3·H2O浓度变化的曲线是_____(填“A”或“B”)。
(2)NH3·H2O的电离常数为_____。
(3)当加入盐酸体积为50 mL时,溶液中c(NH4+)-c(NH3·H2O)=___ mol·L-1(用数字表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二硫化钨(WS2,WS2中W的化合价为+4)可用作润滑剂及石油化工领域中的催化剂。由钨铁矿(其主要成分是FeWO4,还含少量Al2O3)制备二硫化钨的工艺流程如下:
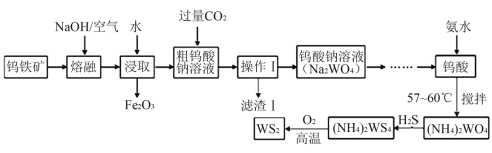
请回答下列问题:
(1)“滤渣Ⅰ”的化学式为__________;
(2)提高“熔融”速率的措施有_____________________(写一条即可);
(3)用离子方程式表示通入过量CO2的主要目的是:________________________;
(4)钨酸与氨水反应时控制温度为58℃,温度不宜太高,其原因是___________。
(5)已知2(NH4)2WS4+3O2![]() 2WS2+4NH3+2S+2SO2+2H2O,若该反应转移了8 mol电子,则生成的气体产物在标准状况下的体积为______L;
2WS2+4NH3+2S+2SO2+2H2O,若该反应转移了8 mol电子,则生成的气体产物在标准状况下的体积为______L;
(6)常温下,Ksp(CaWO4) =1×10-10。在钨酸钠溶液中滴加澄清石灰水产生钨酸钙沉淀,当溶液中pCa=-1g c(Ca2+)=4,c(WO42-)=_____mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.在pH=7的溶液中:Fe3+、K+、Cl-、SO42-
B.滴加KSCN溶液显红色的溶液中:NH4+、K+、Cl-、I-
C.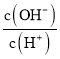 =10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
=10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
D.水电离产生的c(OH-)=10-12 mol/L的溶液中:Na+、Al3+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系。据此判断下列说法中正确的是( )
A. 石墨转变为金刚石是吸热反应
石墨转变为金刚石是吸热反应
B.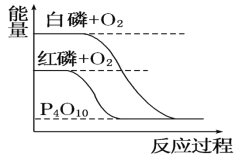 白磷比红磷稳定
白磷比红磷稳定
C.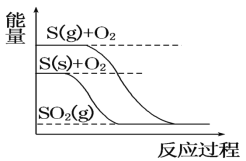 S(g)+O2(g)=SO2(g) ΔH1,S(s)+O2(g)=SO2(g) ΔH2,则ΔH1>ΔH2
S(g)+O2(g)=SO2(g) ΔH1,S(s)+O2(g)=SO2(g) ΔH2,则ΔH1>ΔH2
D.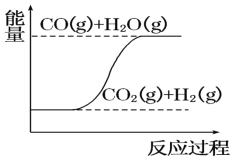 CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中山大学中山医学院颜光美教授课题组发现一种叫![]() 的天然病毒(属于蛋白质),其能杀死癌细胞而不伤害正常细胞,该病毒含有C、H、O、N、S等元素,其直径大约为
的天然病毒(属于蛋白质),其能杀死癌细胞而不伤害正常细胞,该病毒含有C、H、O、N、S等元素,其直径大约为![]() 。下列说法不正确的是( )。
。下列说法不正确的是( )。
A.![]() 病毒中的C、H、O、N、S原子最有可能以共价键结合
病毒中的C、H、O、N、S原子最有可能以共价键结合
B.![]() 病毒不属于高分子化合物
病毒不属于高分子化合物
C.![]() 病毒溶于水形成的液体具有丁达尔效应
病毒溶于水形成的液体具有丁达尔效应
D.![]() 病毒在生物体内的水解产物可能是氨基酸
病毒在生物体内的水解产物可能是氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)水的电离平衡曲线如图所示,若A点表示25 ℃时水的电离达平衡时的离子浓度,B点表示100 ℃时水的电离达平衡时的离子浓度。则100 ℃时pH=12的NaOH溶液100mL,要使它的pH为11。(体积变化忽略不计)
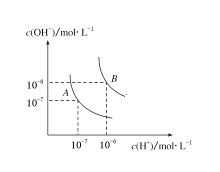
①如果加入蒸馏水,应加_________mL;
②如果加入pH=10的NaOH溶液,应加_________mL;
(2)25 ℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是________(填“促进”、 “抑制”或“不影响”)。
已知如表数据。
化学式 | 电离平衡常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
(3)25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为_________。(填化学式)
(4)25 ℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(Na+)________c(CH3COO-)(填“>”、“<”或“=”)。
(5)向NaCN溶液中通入少量CO2,反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锰广泛应用于医药、食品、农药、造纸等行业,如图是以软锰矿(主要成分是MnO2,还含有SiO2等杂质)和黄铁矿(FeS2)制取MnSO4H2O的流程图,已知Ksp(MnCO3)=2.2×10-11,气体![]() 常用作气体肥料。回答下列问题:
常用作气体肥料。回答下列问题:
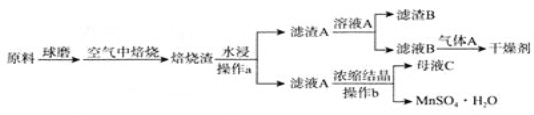
(1)空气中高温焙烧发生反应的化学方程式为________.
(2)气体![]() 的电子式为________。
的电子式为________。
(3)操作a所用的主要玻璃仪器:________。
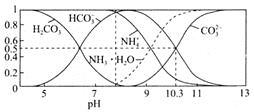
(4)常温下,0.1mol/L碳酸氢铵溶液中微粒浓度分数与pH的关系如图所示,取一定量母液C加入NH4HCO3至其浓度为0.1mol/L可制得高性能强磁性材料MnCO3,该反应的离子方程式为________![]() 同时调pH=10.3,则溶液中c(Mn2+)=________.
同时调pH=10.3,则溶液中c(Mn2+)=________.
(5)硫酸锰是工业制备MnO2电极的活性原料,则用惰性电极电解酸性母液C制得MnO2的阳极电极反应式为________![]() 若电路中通过0.3mol电子时,理论上得到MnO2的质量为________g。
若电路中通过0.3mol电子时,理论上得到MnO2的质量为________g。
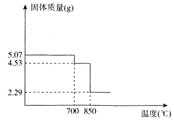
(6)如图是MnSO4H2O的热重曲线,则850℃时固体化学式为________.700℃时发生反应的化学方程式是________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com