
| A. | 原电池是利用氧化还原反应将化学能转化成电能的装置 | |
| B. | 金属A与B用导线连接后插入稀硫酸中组成原电池时,A是正极,则B的金属性强于A | |
| C. | 化学反应达到平衡状态时,只要条件不改变,各物质的浓度就不再改变 | |
| D. | 对于反应N2(g)+3H2(g)?2NH3(g),单位时间里每增加1molN2,同时增加3molH2,说明反应到化学平衡状态 |
分析 A、根据原电池的构成条件和能量转化知识来回答;
B、负材料比正极材料活泼性强;
C、平衡标志是正逆反应速率相同,各成分浓度不变;
D、单位时间里每增加1molN2,同时增加3molH2,都体现的是逆向,未体现正与逆的关系.
解答 解:A、只有自发的氧化还原反应才能设计成原电池,原电池是利用氧化还原反应将化学能转换为电能的装置,故A正确;
B、金属A与B用导线连接后插入稀硫酸中组成原电池时,A是正极,B是负极,所以B的金属性强于A,故B正确;
C、平衡标志是正逆反应速率相同,各成分浓度不变,化学反应达到平衡状态时,只要条件不改变各物质的浓度就不再改变,故C正确;
D、单位时间里每增加1molN2,同时增加3molH2,都体现的是逆向,未体现正与逆的关系,所以不一定是平衡状态,故D错误;
故选D.
点评 本题考查了电化学和影响化学平衡的因素分析判断,平衡标志的判断依据,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 15种 | B. | 13种 | C. | 11种 | D. | 9种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | A | B | C | |||||
| 3 | D | E | F | G | H | |||
| 4 | I | J |
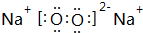 ,该化合物是由离子和共价键形成.
,该化合物是由离子和共价键形成.| 实验步骤 | 实验现象 |
| ①将E单质用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | 1.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②向新制的Na2G溶液中滴加新制的单质H的水溶液 | 2.有气体产生,溶液变成浅红色 |
| ③将一小块金属D放入滴有酚酞溶液的冷水中 | 3.剧烈反应,迅速产生大量无色气体. |
| ④将单质E投入稀盐酸中 | 4.反应开始不十分剧烈,产生无色气体. |
| ⑤将单质F投入稀盐酸中 | 5.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向FH3溶液中滴加DOH溶液至过量 | 6.生成淡黄色沉淀. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
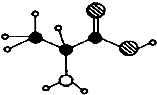
| A. | 能与浓硝酸作用显黄色 | |
| B. | 在一定条件下,可以发生聚合反应生成高分子化合物 | |
| C. | 与盐酸不反应 | |
| D. | 与NaHCO3溶液不反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
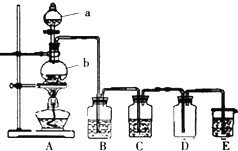
| A. | 浓盐酸和二氧化锰反应制取Cl2 | B. | 稀硫酸和大理石反应制取CO2 | ||
| C. | 浓硝酸与铜反应制取NO2 | D. | 二氧化锰固体和双氧水反应制取O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
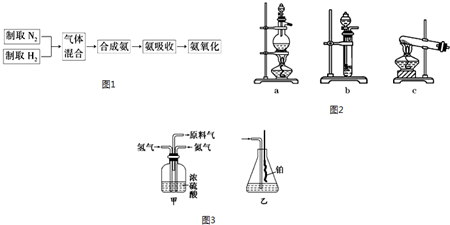
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 金属 | 冶炼原理 | |
| A | Fe | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2 |
| B | Hg | 2HgO $\frac{\underline{\;\;△\;\;}}{\;}$ 2Hg+O2↑ |
| C | Al | 2AlCl3(熔融)$\frac{\underline{\;通电\;}}{\;}$ 2Al+3Cl3↑ |
| D | Na | 2NaCl(熔融)$\frac{\underline{\;通电\;}}{\;}$ 2Na+Cl2↑ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com